Le phosphate de magnésium (Mg3(PO4)2) est un composé composé d’ions magnésium et phosphate. Il joue un rôle vital dans de nombreux processus biologiques tels que la synthèse de l’ADN, la fonction nerveuse et la contraction musculaire.
| Nom UICPA | Phosphate de magnésium |
| Formule moléculaire | Mg3(PO4)2 |
| Numero CAS | 7757-87-1 |
| Synonymes | Phosphate de trimagnésium, orthophosphate de trimagnésium, orthophosphate de magnésium, phosphate tertiaire de magnésium, phosphate tribasique de magnésium |
| InChI | InChI=1S/2Mg.3H3O4P/c;;3 1-5(2,3)4/h;;3 (H3,1,2,3,4)/q2*+2;;;/p-6 |
Propriétés du phosphate de magnésium
Formule de phosphate de magnésium
La formule chimique du phosphate de magnésium est Mg3(PO4)2, ce qui indique qu’il contient trois ions Mg+2 et deux ions PO43-. La formule est essentielle dans les calculs stœchiométriques et aide à déterminer la quantité correcte de réactifs et de produits dans les réactions chimiques impliquant Mg3(PO4)2.
Phosphate De Magnésium Masse molaire
Mg3(PO4)2 a une masse molaire de 262,86 g/mol. Cette valeur représente la masse d’une mole de composé Mg3(PO4)2, qui est une combinaison de trois ions Mg+2 et de deux ions PO4-. La masse molaire est une propriété cruciale utilisée dans les calculs stoechiométriques pour déterminer la quantité de Mg3(PO4)2 nécessaire dans diverses réactions chimiques.
Point d’ébullition du phosphate de magnésium
Le Mg3(PO4)2 n’a pas de point d’ébullition défini puisqu’il se décompose avant d’atteindre son point d’ébullition. À haute température, Mg3(PO4)2 se décompose en oxyde de magnésium et pentoxyde de phosphore, qui ont des points d’ébullition de 3 600°C et 300°C, respectivement. La température de décomposition du Mg3(PO4)2 dépend de divers facteurs tels que la concentration, la vitesse de chauffage et la pression.
Point de fusion du phosphate de magnésium
Le Mg3(PO4)2 a un point de fusion de 1 188°C. A cette température, le composé subit un changement de phase de l’état solide à l’état liquide. Le point de fusion du Mg3(PO4)2 est influencé par divers facteurs, notamment la pression, les impuretés et la structure cristalline.
Densité du phosphate de magnésium g/mL
La densité de Mg3(PO4)2 varie en fonction de la structure cristalline et des conditions dans lesquelles elle est mesurée. La forme la plus courante de Mg3(PO4)2, le tri-Mg3(PO4)2, a une densité de 2,195 g/mL. La valeur de densité est essentielle pour déterminer la masse de Mg3(PO4)2 requise pour atteindre un volume spécifique dans diverses applications.
Phosphate De Magnésium Poids moléculaire
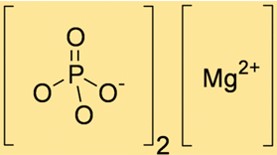
Mg3(PO4)2 a un poids moléculaire de 262,86 g/mol. Cette valeur est calculée en additionnant les poids atomiques des ions Mg et PO43- présents dans le composé. Le poids moléculaire de Mg3(PO4)2 est utile pour déterminer la quantité de Mg3(PO4)2 nécessaire dans diverses réactions chimiques.
Structure du phosphate de magnésium
Mg3(PO4)2 a une structure cristalline qui varie en fonction de la méthode et des conditions de préparation. La forme la plus courante est le tri-Mg3(PO4)2, qui possède une structure cristalline composée d’ions Mg+2 et d’ions PO43- disposés dans un réseau hexagonal. La structure cristalline influence les propriétés physiques et chimiques du Mg3(PO4)2.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 2.195 |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 262,86 g/mole |
| Densité | 2,195 g/ml |
| Point de fusion | 1 188 °C |
| Point d’ébullition | Se décompose avant le point d’ébullition |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Soluble dans les acides |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 7.2 |
| pH | 8-9 (solution à 10 %) |
Sécurité et dangers du phosphate de magnésium
Le Mg3(PO4)2 est généralement considéré comme sûr et non toxique. Il n’est pas classé comme matière dangereuse et ne présente pas de risques significatifs pour la santé humaine ou l’environnement. Cependant, une exposition prolongée à des concentrations élevées de poussières de Mg3(PO4)2 peut provoquer une irritation respiratoire. L’ingestion de grandes quantités de Mg3(PO4)2 peut provoquer une irritation gastro-intestinale et des nausées. Il est important de manipuler Mg3(PO4)2 avec précaution et de porter un équipement de protection individuelle approprié lors de la manipulation de grandes quantités du composé. Tout déversement ou fuite doit être rapidement nettoyé pour éviter tout risque de glissade ou de chute.
| Symboles de danger | Aucun |
| Description de la sécurité | Non classé comme dangereux |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 2835.29.10 |
| Classe de danger | Non classés |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Non toxique à des concentrations normales |
Méthodes de synthèse du phosphate de magnésium
Plusieurs méthodes peuvent synthétiser le Mg3(PO4)2, notamment la précipitation, la réaction de l’oxyde de magnésium avec l’acide phosphorique et la réaction de l’hydroxyde de magnésium avec l’acide phosphorique.
Le procédé de précipitation consiste à ajouter un sel de phosphate soluble, tel que Na3PO4, à une solution contenant un sel de Mg+2 soluble, tel que MgCl2 ou du sulfate de magnésium. Ensuite, le mélange des deux solutions produit un précipité de Mg3(PO4)2 que l’on peut collecter et sécher.
La réaction consiste à ajouter de l’oxyde de magnésium à une solution d’ acide phosphorique et à chauffer le mélange pour mener la réaction à son terme. Le processus collecte et lave ensuite le Mg3(PO4)2 résultant pour éliminer toutes les impuretés.
La réaction consiste à ajouter de l’hydroxyde de magnésium à une solution d’ acide phosphorique et à chauffer le mélange pour le mener à son terme. Ensuite, récupérez le Mg3(PO4)2 obtenu et lavez-le soigneusement pour éliminer toutes les impuretés.
En fonction de la qualité des matières premières et des conditions de réaction, on peut utiliser ces méthodes pour produire du Mg3(PO4)2 avec différents degrés de pureté.
Utilisations du phosphate de magnésium
Le Mg3(PO4)2 a plusieurs utilisations dans diverses industries, notamment :
- Industrie alimentaire : Utilisé comme additif alimentaire pour réguler les niveaux d’acidité et améliorer la texture et la qualité des produits de boulangerie, des produits laitiers et des boissons.
- Agriculture : Utilisé comme engrais pour fournir aux plantes des nutriments essentiels tels que le magnésium et le phosphore.
- Industrie pharmaceutique : Utilisé comme ingrédient actif dans les antiacides et les laxatifs pour aider à soulager les symptômes d’indigestion et de constipation.
- Traitement de l’eau : Utilisé comme produit chimique de traitement de l’eau pour contrôler la formation de tartre dans les chaudières et les tuyaux et pour prévenir la corrosion.
- Industrie céramique : Utilisé comme liant céramique pour améliorer la résistance et la durabilité des produits céramiques.
- Ignifugation : Utilisé comme ignifuge dans les matériaux de construction tels que l’isolation, les cloisons sèches et les revêtements.
- Cosmétiques : Utilisé dans les cosmétiques et les produits de soins personnels comme épaississant et émulsifiant.
Des questions:
Q : Quelle est la formule correcte pour le composé formé entre les ions Mg+2 et PO43- ?
R : La formule correcte pour le composé formé entre les ions Mg+2 et les ions PO43- est Mg3(PO4)2.
Q : Quelle est la formule du phosphate de magnésium ?
R : La formule du phosphate de magnésium est Mg3(PO4)2.
Q : Combien d’ions composent une unité de formule de phosphate de magnésium ?
R : Une unité de formule de Mg3(PO4)2 contient 11 ions : trois ions Mg+2 et deux ions PO43-.
Q : Le phosphate de magnésium est-il soluble ?
R : Mg3(PO4)2 a une faible solubilité dans l’eau, avec une solubilité d’environ 0,1 g/100 mL à température ambiante.
Q : Un acide (x) réagit avec une base (y) pour produire du Mg3(PO4)2. Que sont x et y ?
R : L’acide (x) est l’acide phosphorique (H3PO4) et la base (y) est l’hydroxyde de magnésium (Mg(OH)2).
Q : Quelle est la masse molaire de Mg3(PO4)2, une substance autrefois utilisée en médecine comme antiacide ?
R : La masse molaire de Mg3(PO4)2 est de 262,86 g/mol.
Q : Le Mg3(PO4)2 est-il soluble dans l’eau ?
R : Mg3(PO4)2 a une faible solubilité dans l’eau, avec une solubilité d’environ 0,1 g/100 mL à température ambiante.
Q : Combien de moles d’atomes d’oxygène y a-t-il dans une mole de Mg3(PO4)2 ?
R : Une mole de Mg3(PO4)2 contient 8 moles d’atomes d’oxygène.
