Le phosphate de calcium (Ca3(PO4)2) est un minéral présent dans les dents et les os. Cela contribue à les rendre forts et en bonne santé. Il est également utilisé comme complément alimentaire pour prévenir les carences en calcium.
| Nom UICPA | Le phosphate de calcium |
| Formule moléculaire | Ca3(PO4)2 |
| Numero CAS | 7758-87-4 |
| Synonymes | Phosphate tricalcique, phosphate osseux, orthophosphate de calcium, phosphate de calcium tribasique, TCP |
| InChI | InChI=1S/3Ca.2H3O4P/c;;;2 1-5(2,3)4/h;;;2 (H3,1,2,3,4)/q3*+2;;/p-6 |
Propriétés du phosphate de calcium
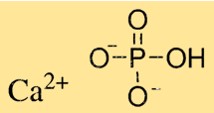
Formule de phosphate de calcium
La formule chimique du phosphate de calcium est Ca3(PO4)2, ce qui indique qu’il contient trois ions calcium et deux ions phosphate. La formule est utilisée pour calculer la quantité de phosphate de calcium nécessaire aux réactions chimiques. Le phosphate de calcium est un composant important des dents et des os et est également utilisé dans diverses applications industrielles, telles que les additifs alimentaires et les engrais.
Phosphate De Calcium Masse molaire
La masse molaire de Ca3(PO4)2 est de 310,18 g/mol. Il est calculé en additionnant la masse atomique du calcium, du phosphore et de l’oxygène, qui sont respectivement de 40,08 g/mol, 30,97 g/mol et 15,99 g/mol. La masse molaire est un paramètre important pour déterminer la quantité de Ca3(PO4)2 nécessaire dans une réaction chimique.
Point d’ébullition du phosphate de calcium
Le Ca3(PO4)2 n’a pas de point d’ébullition défini, car il se décompose avant d’atteindre son point d’ébullition. Lorsqu’il est chauffé, le Ca3(PO4)2 se décompose en oxyde de calcium et en pentoxyde de phosphore, libérant de la vapeur d’eau. La température de décomposition dépend du type de Ca3(PO4)2 et de la vitesse de chauffage.
Point de fusion du phosphate de calcium
Le point de fusion du Ca3(PO4)2 dépend du type de Ca3(PO4)2. Le point de fusion du phosphate tricalcique, la forme la plus abondante de Ca3(PO4)2 dans la nature, est d’environ 1 670 °C. Le phosphate dicalcique a un point de fusion d’environ 1 400 °C, tandis que le phosphate monocalcique fond à environ 109 °C.
Densité du phosphate de calcium g/mL
La densité de Ca3(PO4)2 varie en fonction du type de Ca3(PO4)2. Le phosphate tricalcique a une densité d’environ 3,14 g/mL, tandis que le phosphate dicalcique a une densité d’environ 2,31 g/mL. Le phosphate monocalcique a une densité d’environ 2,22 g/mL.
Phosphate De Calcium Poids moléculaire
Le poids moléculaire de Ca3(PO4)2 est de 310,18 g/mol, ce qui correspond à la somme des poids atomiques du calcium, du phosphore et de l’oxygène. Le poids moléculaire est important pour calculer la quantité de Ca3(PO4)2 nécessaire aux réactions chimiques.
Structure du phosphate de calcium
Ca3(PO4)2 a une structure cristalline complexe qui dépend du type de Ca3(PO4)2. Le phosphate tricalcique a une structure cristalline hexagonale, tandis que le phosphate dicalcique a une structure cristalline monoclinique. Le phosphate monocalcique a une structure cristalline tétragonale. Les cristaux de Ca3(PO4)2 sont composés d’ions calcium et d’ions phosphate disposés selon un motif spécifique.
| Apparence | Poudre ou cristaux blancs |
| Gravité spécifique | 3.14 |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 310,18 g/mole |
| Densité | 3,14 g/mL (phosphate tricalcique) |
| Point de fusion | 1670 °C (phosphate tricalcique) |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N / A |
| Solubilité dans l’eau | 0,002 g/100 ml (à 25 °C) |
| Solubilité | Soluble dans les acides, insoluble dans l’eau |
| Pression de vapeur | N / A |
| Densité de vapeur | N / A |
| pKa | pKa1 : 1,9, pKa2 : 6,7, pKa3 : 12,0 |
| pH | 5,5-7,5 (suspension à 10 % dans l’eau) |
Sécurité et dangers du phosphate de calcium
Le Ca3(PO4)2 est généralement considéré comme sans danger pour la consommation humaine et ne présente aucun risque significatif pour la santé. C’est un minéral naturel présent dans les os et les dents et utilisé comme complément alimentaire sous de nombreuses formes. Le Ca3(PO4)2 est également utilisé dans l’industrie alimentaire comme additif alimentaire et comme conditionneur de pâte. Cependant, une consommation excessive de suppléments de Ca3(PO4)2 peut entraîner des effets indésirables, tels que des maux d’estomac, de la constipation et même des lésions rénales. De plus, l’exposition à des niveaux élevés de poussière de Ca3(PO4)2 sur le lieu de travail peut provoquer des problèmes respiratoires. Par conséquent, il est important d’utiliser les suppléments et produits Ca3(PO4)2 avec modération et de suivre les consignes de sécurité en milieu industriel.
| Symboles de danger | Aucun connu |
| Description de la sécurité | 26-36/37/39 : Porter des vêtements de protection appropriés, des gants et un équipement de protection des yeux/du visage. |
| Numéros d’identification de l’ONU | N / A |
| Code SH | 28352500 |
| Classe de danger | Non classés |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité |
Méthodes de synthèse du phosphate de calcium
Il existe plusieurs méthodes de synthèse du Ca3(PO4)2, notamment la précipitation, la synthèse hydrothermale, le procédé sol-gel et la réaction à l’état solide.
La méthode de précipitation consiste à combiner des ions calcium et phosphate dans une solution aqueuse, ce qui entraîne la formation d’un précipité par réaction chimique. L’expérimentateur lave et sèche ensuite le précipité pour obtenir le composé Ca3(PO4)2 souhaité.
La synthèse hydrothermale implique la réaction de sources de calcium et de phosphate dans un environnement à haute pression et à haute température. Pour obtenir le composé Ca3(PO4)2 souhaité, on lave et sèche le produit résultant.
Dans le processus sol-gel, on convertit un sol, ou suspension colloïdale, en gel puis on le sèche pour obtenir le composé Ca3(PO4)2 souhaité. Cette méthode permet un contrôle précis de la composition et de la morphologie du composé obtenu.
La réaction à l’état solide implique le mélange de pyrophosphate de calcium et de carbonate de calcium à l’état solide, puis le chauffage du mélange pour favoriser une réaction chimique. Pour obtenir le composé Ca3(PO4)2 souhaité, il faut laver et sécher le produit obtenu.
Utilisations du phosphate de calcium
Le Ca3(PO4)2 a de nombreuses utilisations dans différentes industries en raison de ses propriétés uniques. Certaines des utilisations courantes du Ca3(PO4)2 sont :
- Compléments alimentaires : Couramment utilisé dans les compléments alimentaires comme source de calcium et de phosphore, qui sont des minéraux essentiels à la santé des os.
- Industrie alimentaire et des boissons : utilisé comme additif alimentaire dans de nombreux aliments transformés, notamment les produits de boulangerie, les produits laitiers et les boissons. En pâtisserie, les gens l’utilisent comme agent levant et source de calcium.
- Industrie pharmaceutique : Utilisé dans l’industrie pharmaceutique comme agent de remplissage et de liant dans les comprimés et les capsules. Certains médicaments peuvent voir leur biodisponibilité améliorée en les utilisant comme agent d’enrobage.
- Agriculture : Utilisé comme engrais pour fournir aux plantes des nutriments essentiels comme le calcium et le phosphore.
- Dentisterie : Utilisé en dentisterie pour reminéraliser les dents et restaurer l’émail des dents.
- Génie biomédical : également utilisé en génie biomédical pour développer des substituts de greffe osseuse et pour améliorer les propriétés des biomatériaux utilisés dans l’ingénierie des tissus osseux.
Des questions:
Q : Pourquoi l’ajout d’acide augmente-t-il la solubilité du phosphate de calcium ?
R : L’ajout d’acide augmente la solubilité du Ca3(PO4)2 en protonant les ions phosphate, ce qui les rend plus solubles dans l’eau. Les ions phosphate protonés forment du Ca3(PO4)2 acide, qui est plus soluble que la forme neutre.
Q : Combien de grammes de phosphore y a-t-il dans 500,0 grammes de phosphate de calcium ?
R : La masse molaire de Ca3(PO4)2 est de 310,18 g/mol. Le composé a un rapport phosphore/calcium de 2:3, donc la masse molaire du phosphore est de 30,97 g/mol. Il y a donc 81,62 grammes de phosphore dans 500,0 grammes de Ca3(PO4)2.
Q : Le phosphate de calcium est-il soluble ?
R : Ca3(PO4)2 a une faible solubilité dans l’eau, avec un produit de solubilité de 1,8 x 10^-29. Cependant, sa solubilité peut être augmentée par l’ajout d’acides.
Q : Quel est le pourcentage d’oxygène, en masse, dans le phosphate de calcium ?
R : La masse molaire de Ca3(PO4)2 est de 310,18 g/mol. La masse atomique de l’oxygène est de 16,00 g/mol et il y a 8 atomes d’oxygène dans une mole de Ca3(PO4)2. Par conséquent, la masse d’oxygène dans une mole de Ca3(PO4)2 est de 8 x 16,00 = 128,00 g. La masse de Ca3(PO4)2 est de 310,18 g, donc le pourcentage d’oxygène, en masse, est de (128,00 g / 310,18 g) x 100 % = 41,23 %.
Q : Le Ca3(PO4)2 est-il soluble dans l’eau ?
R : Ca3(PO4)2 n’est pas très soluble dans l’eau, avec un produit de solubilité de 1,3 x 10^-33.
Q : Quelle est la masse molaire de Ca3(PO4)2 ?
R : La masse molaire de Ca3(PO4)2 est de 310,18 g/mol.
Q : Qu’est-ce que Ca3(PO4)2 ?
R : Ca3(PO4)2 est un composé chimique composé de trois ions Ca2+ et de deux ions PO43-. C’est une poudre blanche, inodore et insoluble dans l’eau.
Q : Quelle est la masse de formule en grammes de Ca3(PO4)2 ?
R : La masse de formule en grammes de Ca3(PO4)2 est de 310,18 g/mol.
