Le phosgène est un gaz toxique utilisé dans les processus industriels et dans la guerre. Son inhalation présente de graves risques pour la santé, provoquant des lésions respiratoires et peut être mortelle.
| Nom UICPA | Dichlorure de carbonyle |
| Formule moléculaire | COCl2 |
| Numero CAS | 75-44-5 |
| Synonymes | Dichlorure carbonique, gaz phosgène, chlorure de carbonyle |
| InChI | InChI=1S/CCl2O/c2-1(3)4 |
Propriétés du phosgène
Formule Phosgène
La formule chimique du phosgène ou dichlorure de carbone est COCl2. Il se compose d’un atome de carbone (C), d’un atome d’oxygène (O) et de deux atomes de chlore (Cl). Cette composition moléculaire est essentielle pour comprendre ses propriétés et ses réactions.
Phosgène Masse molaire
La masse molaire du dichlorure de carbone est d’environ 98,92 g/mol. Il est calculé en additionnant les masses atomiques de ses constituants, qui sont le carbone (12,01 g/mol), l’oxygène (16,00 g/mol) et le chlore (35,45 g/mol chacun).
Point d’ébullition du phosgène
Le dichlorure carbonique a un point d’ébullition relativement bas d’environ -23,3°C (-9,94°F). À cette température, il passe de son état liquide à un état gazeux, ce qui est crucial pour son application dans divers procédés industriels.
Phosgène Point de fusion
Le point de fusion du dichlorure carbonique est assez bas, autour de -118,3°C (-180,94°F). À cette température, la forme solide du dichlorure de carbone se transforme en liquide. Comprendre cette propriété est important pour manipuler le dichlorure de carbone en toute sécurité.
Densité du phosgène g/mL
Le dichlorure carbonique a une densité d’environ 1,432 g/mL à température ambiante (25°C ou 77°F). Cette propriété est cruciale pour déterminer son comportement et ses interactions avec d’autres substances.
Phosgène Poids moléculaire
Le poids moléculaire du dichlorure de carbone est de 98,92 g/mol. Cette valeur est vitale pour divers calculs en chimie, notamment la stœchiométrie et la détermination de la quantité de dichlorure de carbone nécessaire aux réactions.
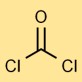
Structure du phosgène
Le dichlorure carbonique a une structure moléculaire linéaire, dans laquelle l’atome de carbone est doublement lié à l’atome d’oxygène et simplement lié à chaque atome de chlore. Cet agencement affecte sa réactivité et sa stabilité.
Solubilité du phosgène
Le dichlorure carbonique est peu soluble dans l’eau, seule une petite quantité de gaz se dissolvant dans le liquide. Cependant, il peut réagir avec l’eau pour produire de l’acide chlorhydrique et du dioxyde de carbone, ce qui le rend dangereux dans les environnements aqueux.
Comprendre ces propriétés du dichlorure carbonique est essentiel pour manipuler et utiliser le produit chimique en toute sécurité dans des applications industrielles et dans d’autres contextes. Des précautions appropriées doivent toujours être prises lors de la manipulation de ce composé toxique et réactif afin de prévenir les accidents et les risques pour la santé.
| Apparence | Gaz incolore |
| Gravité spécifique | 3.428 (gaz) |
| Couleur | N / A |
| Odeur | Suffocant, piquant |
| Masse molaire | 98,92 g/mole |
| Densité | 1,432 g/mL (liquide) |
| Point de fusion | -118,3 °C (-180,94 °F) |
| Point d’ébullition | -23,3°C (-9,94°F) |
| Point d’éclair | N / A |
| Solubilité dans l’eau | Réagit avec l’eau |
| Solubilité | Réagit avec l’eau pour produire de l’acide chlorhydrique et du dioxyde de carbone |
| La pression de vapeur | 736 mmHg (25 °C) |
| Densité de vapeur | 2,98 (air = 1) |
| pKa | N / A |
| pH | N / A |
Ces propriétés physico-chimiques fournissent des informations essentielles sur le dichlorure de carbone, facilitant sa manipulation en toute sécurité et la compréhension de son comportement dans divers environnements.
Sécurité et dangers du phosgène
Le dichlorure carbonique présente des risques importants pour la sécurité en raison de sa nature toxique et réactive. Lors de la manipulation du dichlorure de carbone, portez un équipement de protection individuelle (EPI) approprié, notamment une protection respiratoire, des gants et une protection oculaire. Assurer une ventilation adéquate dans les zones de travail pour éviter toute exposition par inhalation. Évitez tout contact avec la peau et les yeux car cela peut provoquer de graves irritations et brûlures. Le gaz dichlorure de carbone n’a pas d’odeur, ce qui rend sa détection difficile. Les dispositifs de surveillance sont donc cruciaux. En cas d’exposition, consulter immédiatement un médecin. Stockez et transportez le dichlorure de carbone en toute sécurité, conformément aux réglementations et aux meilleures pratiques. Comprendre ses dangers est essentiel pour prévenir les accidents et protéger à la fois la santé humaine et l’environnement.
| Symboles de danger | Crâne et os croisés |
| Description de la sécurité | Gaz hautement toxique. Manipulez avec une extrême prudence. Utilisez un EPI approprié. Évitez l’inhalation et le contact avec la peau. |
| Numéros d’identification de l’ONU | UN1076 |
| Code SH | 2812.10.0000 |
| Classe de danger | 2.3 (Gaz toxique) |
| Groupe d’emballage | je |
| Toxicité | Le phosgène est hautement toxique et peut être mortel par inhalation ou par contact cutané. Utilisez des mesures de sécurité strictes. |
Comprendre les aspects de risque et de sécurité du dichlorure de carbone est crucial pour une manipulation sûre et la prévention des accidents. Il est hautement toxique et présente des risques importants pour la santé, ce qui rend essentielles des procédures et des précautions de sécurité appropriées.
Méthodes de synthèse du phosgène
Plusieurs méthodes permettent la synthèse du dichlorure de carbone.
Une approche courante est le « processus Deacon », dans lequel le chlore gazeux réagit avec le monoxyde de carbone à des températures élevées en présence d’un catalyseur approprié comme le chlorure de cuivre (II) . Une autre méthode implique la « chloration directe » du monoxyde de carbone avec du chlore gazeux, facilitée par du fer ou d’autres chlorures métalliques comme catalyseurs.
La production de dichlorure carbonique implique la « carbonylation oxydative » du chlorure de méthylène ou du chlorure de méthyle, en utilisant de l’oxygène et un catalyseur métallique comme le chlorure cuivreux. Une autre méthode de synthèse du dichlorure carbonique est la « voie de l’urée », qui génère du dichlorure carbonique comme sous-produit lors de la production d’urée.
Cependant, il est essentiel de noter que le dichlorure de carbone est une substance très dangereuse et que sa synthèse nécessite le plus grand soin et expertise. Les travailleurs doivent effectuer ces processus dans des environnements industriels bien contrôlés avec des mesures de sécurité strictes et des équipements de protection pour éviter l’exposition aux gaz toxiques et assurer leur sécurité et celle de l’environnement.
Utilisations du phosgène
Le dichlorure carbonique a diverses applications industrielles en raison de ses propriétés uniques, mais il est important de noter que ses utilisations doivent être manipulées avec la plus grande prudence en raison de sa nature toxique. Voici quelques-unes de ses utilisations :
- Intermédiaires chimiques : Le dichlorure carbonique aide à produire plusieurs produits chimiques essentiels, notamment les isocyanates, qui jouent un rôle essentiel dans la fabrication de mousses, de revêtements et d’adhésifs en polyuréthane.
- Production de pesticides : Le dichlorure carbonique facilite la synthèse de certains pesticides et herbicides, contribuant ainsi à la protection des cultures et à la lutte antiparasitaire.
- Production de polycarbonate : le dichlorure carbonique est un composant crucial dans la production de plastiques polycarbonates, utilisés dans une large gamme de produits, des lunettes aux bouteilles d’eau.
- Industrie textile : Le dichlorure carbonique participe à la production de colorants spécifiques et d’autres produits chimiques utilisés dans l’industrie textile.
- Production de mousse : Le dichlorure carbonique joue un rôle déterminant dans la fabrication de matériaux en mousse, y compris certains types de mousse utilisés dans l’isolation.
- Produits pharmaceutiques : le dichlorure carbonique agit comme un intermédiaire chimique dans la production de certains produits pharmaceutiques.
- Recherche en laboratoire : Les chercheurs utilisent parfois du dichlorure de carbone dans des expériences en laboratoire.
- Production de caoutchouc synthétique : Le dichlorure carbonique fait partie intégrante de la production de certains caoutchoucs synthétiques.
- Purification de l’eau : Le dichlorure carbonique avait déjà été utilisé en petites quantités pour la purification de l’eau, mais de nos jours, des alternatives plus sûres sont plus couramment utilisées à cette fin.
Bien que le dichlorure de carbone ait d’importantes utilisations industrielles, sa haute toxicité et ses propriétés dangereuses nécessitent des mesures de sécurité strictes lors de la manipulation, du stockage et du transport pour prévenir les accidents et garantir le bien-être des travailleurs et de l’environnement.
Des questions:
Q : Qu’est-ce que le gaz phosgène fait à une personne ?
R : Le dichlorure de carbone gazeux peut provoquer des lésions respiratoires, entraînant des difficultés respiratoires et un œdème pulmonaire potentiellement mortel.
Q : Qu’est-ce que le phosgène ?
R : Le dichlorure carbonique est un composé chimique hautement toxique utilisé dans divers processus industriels.
Q : Qu’est-ce que le gaz phosgène ?
R : Le dichlorure de carbone gazeux est la forme gazeuse du composé chimique, connu pour ses effets suffocants et toxiques sur le système respiratoire.
Q : Qu’est-ce que le phosgène fait au corps ?
R : Le dichlorure carbonique peut endommager les poumons, provoquant une accumulation de liquide et une grave détresse respiratoire.
Q : Combien de fois Grignard réagira-t-il avec le phosgène ?
R : Le réactif de Grignard réagit avec le dichlorure de carbone une seule fois, formant une cétone.
Q : Quel organe humain les gaz chlorés et phosgènes ont-ils attaqué ?
R : Les gaz de chlore et de dichlorure de carbone attaquent principalement les poumons.
Q : Comment le gaz phosgène vous tue-t-il ?
R : Le dichlorure de carbone gazeux provoque une grave irritation des poumons, entraînant une accumulation de liquide et une suffocation.
Q : Qui a inventé le gaz phosgène ?
R : Le gaz dichlorure carbonique a été découvert par le chimiste britannique John Davy en 1812.
Q : Effets du gaz dichlorure de carbone ?
R : Le dichlorure de carbone gazeux peut provoquer des lésions respiratoires, un œdème pulmonaire et, dans les cas graves, la mort.
Q : Structure de Lewis du dichlorure carbonique ?
R : La structure de Lewis du dichlorure carbonique est constituée d’un carbone doublement lié à l’oxygène et d’une simple liaison à deux atomes de chlore.
Q : Gaz dichlorure de carbone Première Guerre mondiale ?
R : Le dichlorure de carbone a été utilisé comme arme chimique pendant la Première Guerre mondiale, provoquant des effets dévastateurs sur les soldats.
Q : Quand le gaz phosgène a-t-il été utilisé pour la première fois ?
R : Le gaz dichlorure de carbone a été utilisé pour la première fois comme arme chimique pendant la Première Guerre mondiale, en 1915.
Q : D’où vient le phosgène ?
R : Le dichlorure carbonique est généralement produit par réaction du chlore avec du monoxyde de carbone ou d’autres composés contenant du carbone.
