Le persulfate d’ammonium ((NH4)2S2O8) est une poudre blanche. Il se dissout dans l’eau et libère de l’oxygène. Il peut blanchir, graver ou initier une polymérisation.
| Nom de l’UICPA | Peroxydisulfate d’ammonium |
| Formule moléculaire | (NH4)2S2O8 |
| Numero CAS | 7727-54-0 |
| Synonymes | Persulfate d’ammonium, Peroxodisulfate d’ammonium, Persulfate de diammonium, Peroxydisulfate de diammonium |
| InChI | InChI=1S/2H3N.H2O8S2/c;;1-9(2,3)7-8-10(4,5)6/h2*1H3;(H,1,2,3)(H,4,5 ,6) |
Propriétés du persulfate d’ammonium
Formule de persulfate d’ammonium
La formule du persulfate d’ammonium est (NH4)2S2O8. Il se compose de deux cations ammonium (NH4+) et d’un anion persulfate (S2O82-). L’anion persulfate possède deux groupes sulfate (SO42-) reliés par une liaison peroxyde (OO).
Persulfate D’Ammonium Masse molaire
La masse molaire de (NH4)2S2O8 est 228,18 g/mol. Ceci est calculé en additionnant les masses atomiques de tous les atomes dans la formule : 2 x 14,01 (N) + 8 x 1,01 (H) + 2 x 32,06 (S) + 8 x 16,00 (O).
Point d’ébullition du persulfate d’ammonium
Le (NH4)2S2O8 n’a pas de point d’ébullition car il se décompose avant d’atteindre cette température. Il se décompose à environ 120 °C (248 °F) en ammoniac, azote, oxygène et eau. La réaction de décomposition est :
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
Persulfate d’ammonium Point de fusion
Le (NH4)2S2O8 n’a pas de point de fusion car il se décompose avant d’atteindre cette température. Il se décompose à environ 120 °C (248 °F) en ammoniac, azote, oxygène et eau. La réaction de décomposition est :
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
Densité du persulfate d’ammonium g/mL
La densité du (NH4)2S2O8 est de 1,98 g/mL à 25 °C. Cela signifie qu’un millilitre de (NH4)2S2O8 pèse 1,98 grammes.
Persulfate D’Ammonium Poids moléculaire
Le poids moléculaire du (NH4)2S2O8 est le même que sa masse molaire, qui est de 228,18 g/mol. Cela signifie qu’une mole de (NH4)2S2O8 pèse 228,18 grammes.
Structure du persulfate d’ammonium
La structure de (NH4)2S2O8 peut être représentée par la structure de Lewis suivante :
O O
|| ||
O=S||-OOS||=O
|| ||
O O
/\
NH NH
\/
H
/\
NH NH
\/
H
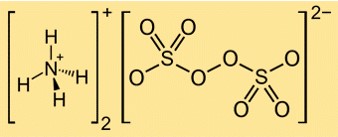
Dans cette structure, chaque atome de soufre est lié à quatre atomes d’oxygène dans une géométrie tétraédrique, et chaque atome d’oxygène possède deux paires d’électrons libres. La liaison peroxyde entre les deux groupes sulfate est une liaison simple avec une paire d’électrons. Les cations ammonium sont formés d’atomes d’azote partageant trois électrons avec trois atomes d’hydrogène chacun et ayant une charge positive.
Solubilité du persulfate d’ammonium
Le (NH4)2S2O8 est très soluble dans l’eau, bien plus que le sel de potassium associé 1 . Il se dissout dans l’eau pour former des ions ammonium et des ions persulfate, qui peuvent se dissocier davantage en radicaux sulfate :
(NH4)2S2O8 -> 2NH4+ + S2O82-
S2O82- -> 2 SO4•-
La solubilité du (NH4)2S2O8 dans l’eau augmente avec l’augmentation de la température. À 25 °C, il peut dissoudre jusqu’à 80 g/100 ml d’eau. Il est également modérément soluble dans le méthanol.
| Apparence | Cristaux blancs à jaunâtres |
| Densité spécifique | 1,98 |
| Couleur | Blanc à jaunâtre |
| Odeur | Doux et désagréable |
| Masse molaire | 228,18 g/mole |
| Densité | 1,98 g/mL à 25 °C |
| Point de fusion | 120 °C (se décompose) |
| Point d’ébullition | N/A (se décompose) |
| Point d’éclair | N / A |
| Solubilité dans l’eau | 80 g/100 mL à 25 °C |
| Solubilité | Modérément soluble dans MeOH |
| Pression de vapeur | N / A |
| Densité de vapeur | N / A |
| pKa | N / A |
| pH | N / A |
Sécurité et dangers du persulfate d’ammonium
Le (NH4)2S2O8 est un agent oxydant puissant qui peut intensifier le feu et réagir de manière explosive avec les matériaux combustibles. Il peut également avoir divers effets sur la santé en cas d’ingestion, d’inhalation ou de contact avec la peau ou les yeux. Il peut irriter la peau, les yeux, le nez, la gorge et les poumons. Il peut également provoquer des réactions allergiques telles qu’une éruption cutanée, de l’asthme ou des difficultés respiratoires. C’est nocif pour la vie aquatique. Il doit donc être manipulé avec précaution et avec un équipement de protection approprié. Il doit être conservé à l’abri de la chaleur, des étincelles, des flammes et de toute autre substance incompatible.
| Symboles de danger | O (oxydant), Xn (nocif), Xi (irritant) |
| Description de la sécurité | S17 (Conserver à l’écart des matières combustibles), S26 (En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin), S36/37/39 (Porter des vêtements de protection appropriés, des gants et un équipement de protection des yeux/du visage), S45 (En cas d’accident ou de malaise, consulter immédiatement un médecin) |
| Numéros d’identification de l’ONU | ONU 1444 |
| Code SH | 28334000 |
| Classe de danger | 5.1 (Matières comburantes) |
| Groupe d’emballage | III |
| Toxicité | DL50 orale rat : 689 mg/kg, CL50 inhalation rat : 2,95 mg/L/4h, DL50 cutanée rat : 2000 mg/kg |
Méthodes de synthèse du persulfate d’ammonium
Diverses méthodes peuvent être utilisées pour préparer le (NH4)2S2O8, qui est un sel inorganique.
L’une des méthodes les plus courantes consiste à électrolyser une solution froide et concentrée de sulfate d’ammonium ((NH4)2SO4) et d’acide sulfurique (H2SO4) .
Cette méthode a été décrite pour la première fois par Hugh Marshall. L’électrolyse consiste à faire passer un courant électrique à travers la solution à l’aide d’une anode en platine et d’une cathode poreuse en argent.
À l’anode, l’électrolyse de l’acide sulfurique produit des ions hydrogénosulfate HSO4-, qui se combinent avec l’eau pour créer des ions persulfate S2O82- et de l’hydrogène gazeux H2. À la cathode, l’oxygène gazeux O2 subit une réduction pour produire du peroxyde d’hydrogène H2O2, qui réagit avec les ions ammonium NH4+ pour former (NH4)2S2O8 (NH4)2S2O8 et de l’eau H2O.
La réaction globale est la suivante :
(NH4)2SO4 + 2 H2SO4 -> (NH4)2S2O8 + 2 H2O + H2 + O2
En refroidissant et en filtrant, on peut cristalliser le (NH4)2S2O8 à partir de la solution électrolytique.
Une autre méthode de préparation du (NH4)2S2O8 est l’oxydation du bisulfate d’ammonium NH4HSO4 avec de l’ozone O3 ou du peroxyde d’hydrogène H2O2 . Cette méthode produit un rendement et une pureté de (NH4)2S2O8 plus élevés que la méthode d’électrolyse. La réaction est :
NH4HSO4 + O3 -> (NH4)2S2O8 + H2O
ou
NH4HSO4 + H2O2 -> (NH4)2S2O8 + 2H2O
Utilisations du persulfate d’ammonium
Le (NH4)2S2O8 est un produit chimique polyvalent qui a de nombreuses utilisations dans diverses industries et applications. Certaines des utilisations les plus courantes sont :
- Il sert d’agent de blanchiment et de précurseur chimique dans la synthèse d’autres composés d’importance industrielle.
- Il initie le processus de polymérisation et les fabricants l’utilisent principalement dans la production de polystyrène.
- Les fabricants de PCB l’utilisent comme agent de gravure pour éliminer le cuivre et d’autres métaux de la surface.
- Le secteur des semi-conducteurs utilise également le (NH4)2S2O8 comme agent de gravure pour nettoyer et polir les tranches de silicium.
- Les laboratoires l’utilisent comme agent nettoyant et désinfectant pour les équipements, la verrerie et les systèmes d’eau.
- Il empêche le brunissement des fruits et légumes, ce qui en fait un additif utilisé pour conserver les aliments.
- Diverses réactions chimiques l’utilisent comme agent oxydant pour la synthèse de peroxydes organiques, de sulfones et de sulfamides.
- Les batteries l’utilisent comme dépolariseur pour augmenter leurs performances et leur durée de vie.
- Les décolorants capillaires l’utilisent comme ingrédient courant pour éclaircir la couleur des cheveux en oxydant le pigment mélanique.
Des questions:
Q : Combien de temps dure le persulfate d’ammonium ?
R : (NH4)2S2O8 est un composé stable qui peut être stocké indéfiniment à l’état solide sans décomposition. Cependant, il peut perdre de son efficacité avec le temps lorsqu’il est dissous dans l’eau. La durée de conservation d’une solution à 10 % de (NH4)2S2O8 est d’environ 2 à 4 semaines à température ambiante et de 2 à 3 mois à 4 °C 1 2 . La solution doit être protégée de la lumière et de la chaleur et vérifiée périodiquement pour détecter la présence de bulles ou de précipités indiquant une décomposition.
Q : Que fait le persulfate d’ammonium ?
R : (NH4)2S2O8 est un agent oxydant puissant qui peut libérer des radicaux oxygène en solution aqueuse. Ces radicaux peuvent déclencher ou accélérer diverses réactions chimiques, telles que la polymérisation, le blanchiment, la gravure, le nettoyage et la désinfection. (NH4)2S2O8 peut également agir comme source d’ions sulfate pour la synthèse d’autres composés.
Q : Dans quoi mélanger le persulfate d’ammonium ?
R : (NH4)2S2O8 est hautement soluble dans l’eau et peut être mélangé avec de l’eau pour préparer des solutions de différentes concentrations. La solubilité du (NH4)2S2O8 dans l’eau augmente avec l’augmentation de la température. À 25 °C, il peut dissoudre jusqu’à 80 g/100 ml d’eau. Il est également modérément soluble dans le méthanol. Le (NH4)2S2O8 ne doit pas être mélangé avec des substances incompatibles, telles que des matériaux combustibles, des agents réducteurs, des métaux, des acides ou des bases, car il peut réagir violemment ou de manière explosive avec eux.
Q : Le peroxydisulfate d’ammonium est-il identique au persulfate d’ammonium ?
R : Oui, le peroxydisulfate d’ammonium est un autre nom pour (NH4)2S2O8. Ils sont tous deux synonymes du même composé de formule (NH4)2S2O8.
Q : À quoi sert le persulfate d’ammonium dans SDS-PAGE ?
R : SDS-PAGE (électrophorèse sur gel de dodécylsulfate de sodium et de polyacrylamide) est une technique permettant de séparer les protéines en fonction de leur taille et de leur charge. Le (NH4)2S2O8 est utilisé comme catalyseur pour la polymérisation des monomères d’acrylamide et de bisacrylamide pour former une matrice de gel de polyacrylamide. Le (NH4)2S2O8 génère des radicaux libres qui initient la réaction de réticulation entre les monomères.
Q : Comment fabriquer du persulfate d’ammonium à 10 % ?
R : Pour préparer une solution à 10 % de (NH4)2S2O8, pesez 10 g de solide (NH4)2S2O8 et dissolvez-le dans 90 ml d’eau distillée. Remuer jusqu’à dissolution complète et transférer dans une fiole jaugée de 100 ml. Remplissez jusqu’au trait avec de l’eau distillée et mélangez bien. Conservez la solution dans un flacon sombre à 4 °C ou à température ambiante.
Q : Comment réparer un persulfate d’ammonium déclenché par un arc ?
R : Un arc électrique est un défaut causé par un arc électrique qui endommage la surface d’un métal. Cela peut réduire la solidité et la résistance à la corrosion du métal et entraîner des fissures ou des défaillances. Pour réparer un arc électrique, une méthode consiste à utiliser le (NH4)2S2O8 comme agent de gravure pour éliminer la zone affectée. La procédure est la suivante :
- Nettoyez la surface du métal avec de l’acétone ou de l’alcool pour éliminer toute saleté ou graisse.
- Appliquez une fine couche de solution de persulfate d’ammonium (10 à 20 %) sur la zone d’amorçage de l’arc à l’aide d’un pinceau ou d’un coton-tige.
- Attendez 5 à 10 minutes jusqu’à ce que des bulles apparaissent à la surface, indiquant qu’une réaction d’oxydation a lieu.
- Rincer la surface à l’eau et sécher avec un chiffon propre.
- Répétez le processus jusqu’à ce que l’amorçage de l’arc soit complètement supprimé.
- Inspectez la surface à la recherche de fissures ou de piqûres et remplissez-les avec un matériau de remplissage approprié si nécessaire.
- Appliquez un revêtement protecteur ou une peinture pour éviter une corrosion supplémentaire.
Q : Le persulfate d’ammonium est-il un tensioactif ?
R : Non, (NH4)2S2O8 n’est pas un tensioactif. Un tensioactif est une substance qui réduit la tension superficielle d’un liquide ou entre deux liquides, et peut former des micelles ou des émulsions. Le (NH4)2S2O8 ne possède pas ces propriétés. C’est un agent oxydant qui peut libérer des radicaux oxygène en solution aqueuse.
Q : Quels aspects de votre expérience sont contrôlés par TEMED et le persulfate d’ammonium ?
R : TEMED et (NH4)2S2O8 sont utilisés pour contrôler la polymérisation des monomères d’acrylamide et de bisacrylamide afin de former une matrice de gel de polyacrylamide pour l’électrophorèse. TEMED et (NH4)2S2O8 agissent comme des catalyseurs générant des radicaux libres qui initient et accélèrent la réaction de réticulation entre les monomères. La concentration et le rapport de TEMED et (NH4)2S2O8 affectent la vitesse et l’intégralité de la polymérisation, ainsi que la taille des pores et la résistance mécanique du gel.
Q : Le persulfate d’ammonium réagit-il avec l’air ?
R : Oui, le (NH4)2S2O8 peut réagir avec l’air, en particulier dans des conditions humides. Le (NH4)2S2O8 peut absorber l’humidité de l’air et subir une hydrolyse, formant du sulfate d’ammonium et du peroxyde d’hydrogène. Le peroxyde d’hydrogène peut se décomposer davantage en eau et en oxygène gazeux, libérant de la chaleur et de la pression. Cela peut provoquer la rupture ou l’explosion du récipient de (NH4)2S2O8 s’il n’est pas correctement ventilé. Le (NH4)2S2O8 peut également réagir avec l’oxygène de l’air et former de l’ozone, qui est un gaz toxique. Par conséquent, le (NH4)2S2O8 doit être stocké dans un endroit frais, sec et bien ventilé, à l’abri de la chaleur, des étincelles, des flammes et de toute autre substance incompatible.
