Le peroxyde d’hydrogène ou H2O2 est un liquide bleu pâle doté de fortes propriétés oxydantes. Il est couramment utilisé comme désinfectant, agent de blanchiment et dans les fusées comme propulseur. À forte concentration, cela peut être nocif.
| Nom UICPA | Dioxyde de dihydrogène |
| Formule moléculaire | H2O2 |
| Numero CAS | 7722-84-1 |
| Synonymes | Dioxyde d’hydrogène, peroxyde, Oxydol, Superoxol, dioxyde d’hydronium, Peroxaan, Asepticper, etc. |
| InChI | InChI=1S/H2O2/c1-2/h1-2H |
Propriétés du peroxyde d’hydrogène
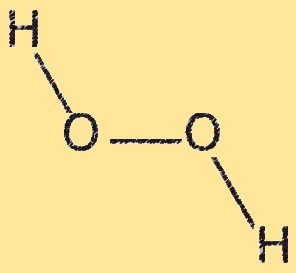
Structure H2O2
Le peroxyde d’hydrogène a une structure moléculaire courbée, avec un angle d’environ 104,5 degrés entre les deux atomes d’oxygène. La molécule possède deux liaisons OH et une liaison OO. La liaison OO est faible et facilement rompue, ce qui fait du peroxyde d’hydrogène un puissant agent oxydant. La structure courbée du peroxyde d’hydrogène résulte de la répulsion entre les paires libres d’électrons sur les atomes d’oxygène.
Formule de peroxyde d’hydrogène
La formule chimique du peroxyde d’hydrogène est H2O2, ce qui indique que chaque molécule de peroxyde d’hydrogène contient deux atomes d’hydrogène et deux atomes d’oxygène. La formule est une manière concise de représenter la composition moléculaire d’une substance. La formule chimique du peroxyde d’hydrogène est importante pour comprendre ses propriétés et ses réactions avec d’autres substances.
Peroxyde D’hydrogène Masse molaire
Le peroxyde d’hydrogène a une masse molaire d’environ 34,01 g/mol. La masse molaire est la somme des masses atomiques de tous les atomes d’une molécule du composé. Le peroxyde d’hydrogène a deux atomes d’hydrogène et deux atomes d’oxygène dans chaque molécule, sa masse molaire est donc calculée en additionnant la masse atomique de chaque atome. La masse molaire est une propriété importante d’une substance car elle est utilisée dans les calculs de stœchiométrie pour déterminer la quantité de substance présente dans un échantillon donné.
Point d’ébullition du peroxyde d’hydrogène
Le point d’ébullition du peroxyde d’hydrogène est de 150,2 °C (302,4 °F). Cette température est le point auquel la pression de vapeur du liquide est égale à la pression atmosphérique. Au-dessus de cette température, le liquide se transforme en gaz, et en dessous de cette température, il reste à l’état liquide. Le point d’ébullition du peroxyde d’hydrogène est supérieur à celui de l’eau, qui bout à 100 °C, en raison de la présence de liaisons hydrogène intermoléculaires dans le peroxyde d’hydrogène.
Point de fusion du peroxyde d’hydrogène
Le point de fusion du peroxyde d’hydrogène est de -0,43 °C (31,23 °F). Cette température est le point auquel les états solide et liquide d’une substance sont en équilibre. À cette température, la forme solide du peroxyde d’hydrogène fond en liquide. Le point de fusion du peroxyde d’hydrogène est inférieur à celui de l’eau, qui fond à 0 °C, en raison de la nature instable de la molécule de peroxyde d’hydrogène.
Densité du peroxyde d’hydrogène g/mL
La densité du peroxyde d’hydrogène est de 1,11 g/mL à température et pression standard (STP). Cela signifie qu’un millilitre de peroxyde d’hydrogène pèse 1,11 gramme. La densité du peroxyde d’hydrogène est supérieure à celle de l’eau, qui a une densité de 1 g/mL, en raison de la présence d’atomes d’oxygène plus lourds dans le peroxyde d’hydrogène.
Peroxyde d’hydrogène Poids moléculaire
Le poids moléculaire du peroxyde d’hydrogène est de 34,01 g/mol. Cette valeur est calculée en additionnant les masses atomiques de chaque atome dans une molécule de peroxyde d’hydrogène. Le poids moléculaire est une propriété importante d’une substance car il est utilisé dans divers calculs, notamment pour déterminer la concentration de peroxyde d’hydrogène dans une solution.
| Apparence | Liquide clair et incolore |
| Gravité spécifique | 1,11 g/cm3 à 20 °C |
| Couleur | Bleu pâle (forme pure) |
| Odeur | Presque inodore (forme pure) |
| Masse molaire | 34,01 g/mole |
| Densité | 1,11 g/mL à 20 °C |
| Point de fusion | -0,43 °C |
| Point d’ébullition | 150,2 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Complètement miscible à l’eau |
| Solubilité | Soluble dans l’alcool, l’éther et d’autres solvants organiques |
| Pression de vapeur | 23,3 mmHg à 20 °C |
| Densité de vapeur | 1,1 (air = 1) |
| pKa | 11,6 (à 25 °C) |
| pH | 4,5 – 6,0 (solution à 10 %) |
Remarque : Ces valeurs sont des valeurs typiques et peuvent varier en fonction de la pureté, de la concentration et d’autres facteurs.
Sécurité et dangers du peroxyde d’hydrogène
Le peroxyde d’hydrogène peut être dangereux s’il est manipulé incorrectement. C’est un agent oxydant puissant qui peut réagir violemment avec les substances organiques et inorganiques, provoquant potentiellement un incendie ou une explosion. La forme concentrée de peroxyde d’hydrogène est également corrosive et peut provoquer de graves brûlures ou des lésions tissulaires au contact de la peau ou des yeux. L’inhalation de vapeurs de peroxyde d’hydrogène peut irriter les voies respiratoires et son ingestion peut provoquer de graves dommages internes, voire la mort. Par conséquent, des précautions de sécurité appropriées, telles que le port de vêtements et de gants de protection, le fait d’éviter tout contact avec des substances incompatibles et l’utilisation dans un endroit bien ventilé, doivent être prises lors de la manipulation du peroxyde d’hydrogène.
| Symboles de danger | O,C |
| Description de la sécurité | Tenir à l’écart de la chaleur, des étincelles et des flammes. Portez des vêtements et des gants de protection. Évitez tout contact avec la peau, les yeux et les vêtements. Ne respirez pas les vapeurs. En cas d’incendie, utiliser de l’eau pulvérisée, de la mousse, de la poudre chimique ou du dioxyde de carbone. |
| Numéros d’identification de l’ONU | ONU2015 |
| Code SH | 2847.00.00 |
| Classe de danger | 5.1 |
| Groupe d’emballage | II |
| Toxicité | Toxique en cas d’ingestion ou d’inhalation. Provoque de graves brûlures de la peau et des lésions oculaires. Peut provoquer une irritation respiratoire. Peut provoquer un incendie ou une explosion. |
Méthodes de synthèse du peroxyde d’hydrogène
Le peroxyde d’hydrogène peut être synthétisé par diverses méthodes, notamment le procédé à l’anthraquinone, l’autoxydation de la 2-éthylanthrahydroquinone et l’électrolyse de l’acide sulfurique dilué. La méthode la plus courante pour la production commerciale de peroxyde d’hydrogène est le procédé à l’anthraquinone.
Dans le procédé à l’anthraquinone, l’anthraquinone est d’abord hydrogénée pour former de l’anthrahydroquinone, qui est ensuite oxydée avec de l’air en présence d’un catalyseur pour produire du peroxyde d’hydrogène. Le peroxyde d’hydrogène est ensuite extrait et purifié à l’aide de diverses techniques, telles que la distillation et la filtration.
Une autre méthode de synthèse du peroxyde d’hydrogène est l’autoxydation de la 2-éthylanthrahydroquinone. Dans cette méthode, la 2-éthylanthrahydroquinone est exposée à l’air en présence d’un catalyseur alcalin, ce qui favorise l’autoxydation du composé pour produire du peroxyde d’hydrogène.
L’électrolyse de l’acide sulfurique dilué est une autre méthode de synthèse du peroxyde d’hydrogène. Dans cette méthode, l’acide sulfurique dilué est électrolysé à l’aide d’une cellule électrolytique spéciale, qui génère du peroxyde d’hydrogène au niveau de l’une des électrodes.
Le peroxyde d’hydrogène peut également être synthétisé par d’autres méthodes, telles que la synthèse directe à partir d’hydrogène et d’oxygène ou la réduction de peroxydes avec des agents réducteurs. Cependant, ces méthodes ne sont pas couramment utilisées pour la production commerciale de peroxyde d’hydrogène en raison de leur faible efficacité et de leurs problèmes de sécurité.
Utilisations du peroxyde d’hydrogène
Le peroxyde d’hydrogène est un composé chimique polyvalent avec une large gamme d’applications dans diverses industries. Voici quelques utilisations courantes du peroxyde d’hydrogène :
- Les industries du textile, du papier et de la pâte à papier utilisent couramment le H2O2 comme agent de blanchiment pour éliminer la couleur des tissus et de la pâte.
- Les établissements de santé utilisent le H2O2 comme désinfectant efficace pour tuer les bactéries, les virus et les champignons et pour stériliser les équipements et surfaces médicaux.
- Les installations de traitement de l’eau utilisent du H2O2 pour éliminer les impuretés telles que le fer et le manganèse et pour désinfecter l’eau.
- Les teintures capillaires et les produits de blanchiment des dents utilisent du H2O2 pour éclaircir la couleur des cheveux et des dents.
- L’industrie aérospatiale utilise le H2O2 comme propulseur de fusée.
- La production de divers polymères, tels que le polypropylène, le polyéthylène et le polystyrène, implique l’utilisation de H2O2.
- H2O2 est un agent nettoyant utile pour éliminer les taches et la crasse des surfaces et nettoyer les lentilles de contact.
- Le H2O2 est utilisé dans l’industrie alimentaire comme agent de blanchiment et conservateur pour les produits alimentaires.
Dans l’ensemble, la polyvalence du H2O2 en fait un composé chimique précieux avec de nombreuses applications dans diverses industries.
Des questions:
Prix du peroxyde d’hydrogène
Le prix du peroxyde d’hydrogène peut varier considérablement en fonction de divers facteurs tels que la pureté, la concentration et la quantité achetée. En général, le prix du peroxyde d’hydrogène peut varier de quelques centimes par livre pour le peroxyde d’hydrogène de qualité technique à plusieurs dollars par livre pour les qualités de haute pureté utilisées dans des applications spécialisées.
En février 2023, le prix moyen du peroxyde d’hydrogène à 35 % de qualité alimentaire était d’environ 20 à 30 dollars le gallon ou de 0,10 à 0,20 dollars par once liquide. Le peroxyde d’hydrogène de qualité industrielle avec une pureté et une concentration inférieures peut coûter moins cher, généralement entre 1 et 5 dollars le gallon. Cependant, les prix peuvent varier en fonction du fournisseur, de la région et d’autres facteurs.
Où acheter du peroxyde d’hydrogène ?
Le peroxyde d’hydrogène est un composé chimique courant qui peut être acheté auprès de divers fournisseurs, en ligne et dans les magasins physiques. Voici quelques endroits où vous pouvez acheter du peroxyde d’hydrogène :
- Fournisseurs de produits chimiques : les fournisseurs de produits chimiques, tels que Sigma-Aldrich, Fisher Scientific et VWR International, proposent une large gamme de qualités et de concentrations de peroxyde d’hydrogène pour diverses applications.
- Marchés en ligne : les marchés en ligne, tels qu’Amazon, eBay et Alibaba, proposent du peroxyde d’hydrogène provenant de divers fournisseurs, avec différentes qualités et concentrations.
- Épiceries et pharmacies : De nombreuses épiceries et pharmacies vendent du peroxyde d’hydrogène à faible concentration (3 % à 6 %) comme antiseptique pour le nettoyage des plaies et les premiers soins.
- Magasins de fournitures de piscine : le peroxyde d’hydrogène peut être utilisé comme oxydant pour piscine et spa pour maintenir la clarté et la désinfection de l’eau. Les magasins de fournitures de piscine, tels que Leslie’s Pool Supplies, peuvent proposer des produits à base de peroxyde d’hydrogène à cette fin.
