Le peroxyde de sodium (Na2O2) est un puissant agent oxydant. Il réagit violemment avec l’eau pour libérer de l’oxygène et peut enflammer des matériaux combustibles au contact. Il est utilisé dans diverses réactions chimiques et comme désinfectant.
| Nom UICPA | Oxydoperhydrate de sodium |
| Formule moléculaire | Na2O2 |
| Numero CAS | 1313-60-6 |
| Synonymes | Peroxyde de sodium, superoxyde de sodium, dioxyde de disodium, binoxyde de sodium, dioxyde de sodium, NaO2, UN 1507 |
| InChI | InChI=1S/2Na.O2/c;;1-2/q2*+1;-2 |
Propriétés du peroxyde de sodium
Formule de peroxyde de sodium
La formule chimique du peroxyde de sodium est Na2O2. C’est un composé ionique composé de deux cations sodium (Na+) et d’un anion peroxyde (O22-). La formule du peroxyde de sodium est utilisée pour représenter la composition chimique du composé et est importante dans les réactions chimiques impliquant la substance.
Masse molaire du peroxyde de sodium
Le peroxyde de sodium, de formule chimique Na2O2, a une masse molaire de 77,98 g/mol. C’est un composé ionique composé de deux cations sodium (Na+) et d’un anion peroxyde (O22-). La masse molaire du peroxyde de sodium est essentielle pour calculer la quantité de composé nécessaire à diverses réactions chimiques.
Point d’ébullition du peroxyde de sodium
Le peroxyde de sodium a un point d’ébullition très élevé de 657°C (1215°F), ce qui le rend extrêmement stable à haute température. Le composé se décompose avant d’atteindre son point d’ébullition, libérant de l’oxygène gazeux et laissant derrière lui de l’oxyde de sodium. Le point d’ébullition élevé du peroxyde de sodium le rend utile dans les réactions à haute température et les processus industriels où une stabilité thermique élevée est requise.
Point de fusion du peroxyde de sodium
Le peroxyde de sodium a un point de fusion de 675°C (1247°F), ce qui est relativement élevé par rapport à d’autres substances courantes. Il fond pour former un liquide blanc jaunâtre et se décompose au-dessus de son point de fusion pour libérer de l’oxygène gazeux et former de l’oxyde de sodium. Le point de fusion élevé du peroxyde de sodium le rend utile dans les réactions chimiques à haute température.
Densité du peroxyde de sodium g/ml
La densité du peroxyde de sodium est de 2,805 g/mL. C’est une poudre blanche à jaunâtre de densité supérieure à celle de l’eau. La haute densité du peroxyde de sodium le rend utile dans divers processus industriels tels que le blanchiment, la désinfection et la production d’autres produits chimiques.
Poids moléculaire du peroxyde de sodium
Le peroxyde de sodium a un poids moléculaire de 77,98 g/mol. C’est un composé ionique avec deux cations sodium (Na+) et un anion peroxyde (O22-). Le poids moléculaire du peroxyde de sodium est important dans les réactions chimiques impliquant le composé, car il aide à déterminer les quantités de réactifs et de produits.
Structure du peroxyde de sodium
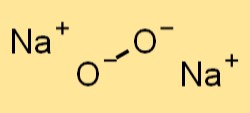
Le peroxyde de sodium a une structure cristalline similaire à celle du chlorure de sodium (NaCl). Il forme un réseau cubique à faces centrées, où les ions sodium occupent les coins du cube et les anions peroxydes sont situés au centre de chaque face. Les anions peroxyde dans le peroxyde de sodium sont maintenus ensemble par des liaisons covalentes, tandis que les ions sodium sont maintenus ensemble par des liaisons ioniques.
| Apparence: | Poudre blanche à jaunâtre |
| Gravité spécifique : | 2,805 g/cm3 |
| Couleur: | Blanc à jaunâtre |
| Odeur: | Inodore |
| Masse molaire: | 77,98 g/mole |
| Densité: | 2,805 g/cm3 |
| Point de fusion: | 675°C (1247°F) |
| Point d’ébullition: | 657°C (1215°F) |
| Point d’éclair: | N’est pas applicable |
| Solubilité dans l’eau : | Réagit violemment avec l’eau |
| Solubilité: | Soluble dans l’alcool, l’éther |
| La pression de vapeur: | N’est pas applicable |
| Densité de vapeur: | N’est pas applicable |
| pKa : | N’est pas applicable |
| PH : | N’est pas applicable |
Sécurité et dangers du peroxyde de sodium
| Symboles de danger : | Oxydant, Corrosif |
| Description de la sécurité : | Ne pas respirer les poussières/fumées/gaz/brouillards/vapeurs. Évitez tout contact avec la peau/les yeux. Manipuler et conserver sous gaz inerte. En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin. En cas d’incendie, utiliser des moyens d’extinction appropriés. |
| Numéros d’identification ONU : | UN1503 |
| Code SH : | 2829.11.00 |
| Classe de danger: | 5.1 |
| Groupe d’emballage : | II |
| Toxicité: | Corrosif pour les yeux et la peau, nocif en cas d’ingestion ou d’inhalation. |
Méthodes de synthèse du peroxyde de sodium
La synthèse du peroxyde de sodium (Na2O2) est possible grâce à plusieurs méthodes, telles que la combinaison directe, la réaction avec l’oxygène et l’électrolyse.
Une méthode de synthèse de Na2O2 est la méthode de combinaison directe. Cela consiste à chauffer du sodium métallique avec un excès d’oxygène dans un four. La réaction est exothermique et il est essentiel de réguler la température pour éviter une surchauffe et une éventuelle explosion.
Une autre méthode implique la réaction de l’hydroxyde de sodium avec le peroxyde d’hydrogène pour produire du Na2O2 et de l’eau. Cette méthode est plus sûre et plus contrôlée que la méthode de combinaison directe mais nécessite une température plus élevée et un temps de réaction plus long.
Une autre méthode de synthèse du Na2O2 consiste à procéder à l’électrolyse. Cela implique l’électrolyse d’une solution d’ hydroxyde de sodium à l’aide d’une anode et d’une cathode appropriées. Pendant l’électrolyse, la cathode produit du Na2O2, tandis que l’anode produit de l’oxygène gazeux.
Utilisations du peroxyde de sodium
Le peroxyde de sodium trouve diverses applications industrielles et en laboratoire en raison de ses propriétés oxydantes et de sa capacité à libérer de l’oxygène.
Voici quelques utilisations courantes du peroxyde de sodium :
- Agent de blanchiment : utilisé comme agent de blanchiment pour la pâte à papier, les textiles et autres matériaux.
- Agent désodorisant : Utilisé comme agent désodorisant dans les installations d’élimination des déchets et de traitement des eaux usées.
- Agent oxydant : utilisé pour oxyder divers composés organiques et inorganiques.
- Polymérisation : Initier la polymérisation de certains monomères. Utilisé dans la production de mousse de polyuréthane et d’autres polymères.
- Applications pharmaceutiques : Utilisé comme réactif dans la synthèse de composés pharmaceutiques.
- Réactif de laboratoire : utilisé comme réactif de laboratoire à diverses fins analytiques et synthétiques.
- Applications des piles à combustible : utilisé comme oxydant dans les piles à combustible pour générer de l’énergie électrique.
Des questions:
Q : Quelle est la réaction chimique entre le peroxyde d’hydrogène et le bisulfite de sodium ?
R : La réaction chimique entre le peroxyde d’hydrogène et le bisulfite de sodium produit de l’eau et du sulfate de sodium. L’équation équilibrée de la réaction est : 2 NaHSO3 + H2O2 → Na2SO4 + 2 H2O.
Q : Où acheter de la poudre de peroxyde de sodium ?
R : La poudre de peroxyde de sodium peut être achetée auprès de divers fournisseurs et distributeurs de produits chimiques. Il est important de s’assurer que le fournisseur est réputé et suit les protocoles de sécurité appropriés pour la manipulation et l’expédition de produits chimiques dangereux.
Q : L’oxyde de sodium peut-il être transformé en borohydrure et en peroxyde d’hydrogène ?
R : L’oxyde de sodium ne peut pas être fabriqué directement à partir de borohydrure et de peroxyde d’hydrogène. L’oxyde de sodium peut être synthétisé par la réaction du sodium métallique avec l’oxygène ou par chauffage de l’hydroxyde de sodium. Le borohydrure et le peroxyde d’hydrogène ne sont pas couramment utilisés dans la synthèse de l’oxyde de sodium.
Q : Quelle est la formule du peroxyde de sodium ?
R : La formule du peroxyde de sodium est Na2O2.
Q : Quel est l’état d’oxydation du Na2O2 ?
R : L’état d’oxydation du sodium dans Na2O2 est +1 et l’état d’oxydation de l’oxygène est -1.
Q : Quel est le nombre d’oxydation de l’oxygène dans le composé Na2O2 ?
R : Le nombre d’oxydation de l’oxygène dans le composé Na2O2 est de -1.
