Le peroxyde de potassium (K2O2) est un composé composé de potassium et d’oxygène. Il est souvent utilisé comme agent oxydant puissant dans les industries et les laboratoires pour faciliter diverses réactions chimiques.
| Nom UICPA | Peroxyoxydanide de potassium |
| Formule moléculaire | K2O2 |
| Numero CAS | 17014-71-0 |
| Synonymes | Superoxyde de potassium ; Dioxyde dipotassique ; Dioxyde de potassium ; Oxyde de perpotassium |
| InChI | InChI=1S/2K.O2/c;;1-2/q2*+1;-2 |
Propriétés du peroxyde de potassium
Formule de peroxyde de potassium
La formule chimique du peroxyde de potassium est K2O2. Cette formule représente le nombre et le type d’atomes présents dans la molécule. La formule est importante pour identifier la substance et comprendre ses propriétés chimiques.
Peroxyde De Potassium Masse molaire
La masse molaire du K2O2 est de 110,2 g/mol. Cela signifie qu’une mole de K2O2 pèse 110,2 grammes. La masse molaire est une propriété importante d’une substance car elle permet de calculer la quantité d’une substance présente dans une masse ou un volume donné.
Point d’ébullition du peroxyde de potassium
Le K2O2 n’a pas de point d’ébullition spécifique, car il se décompose avant d’atteindre son point d’ébullition. À haute température, le K2O2 se décompose en oxyde de potassium et en oxygène gazeux. Par conséquent, il n’est généralement pas utilisé dans les applications à haute température.
Point de fusion du peroxyde de potassium
Le point de fusion du K2O2 est de 655 °C. Ce point de fusion élevé en fait un agent oxydant approprié dans les réactions à haute température. Cependant, il est important de noter qu’il peut se décomposer avant d’atteindre son point de fusion s’il est exposé à des températures élevées ou à l’humidité.
Densité du peroxyde de potassium g/mL
La densité du K2O2 est de 2,08 g/mL. Cette densité élevée en fait un solide dense qui coule dans l’eau. La densité du K2O2 est également importante pour déterminer sa solubilité dans divers solvants.
Peroxyde De Potassium Poids moléculaire
Le poids moléculaire du K2O2 est de 110,2 g/mol. Cette valeur est la somme des poids atomiques de tous les atomes présents dans la molécule. Le poids moléculaire est une propriété importante utilisée pour calculer diverses propriétés d’une substance, notamment sa masse molaire et sa densité.
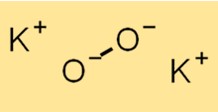
Structure du peroxyde de potassium
La structure du K2O2 est composée d’un cation K+ et d’un anion O2^2-. L’anion O2^2- est constitué de deux atomes d’oxygène liés ensemble de manière covalente. La structure du K2O2 est essentielle pour comprendre ses propriétés chimiques et sa réactivité.
| Apparence | Solide blanc à jaune pâle |
| Gravité spécifique | 2.08 |
| Couleur | Blanc à jaune pâle |
| Odeur | Inodore |
| Masse molaire | 110,2 g/mole |
| Densité | 2,08 g/ml |
| Point de fusion | 655 °C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit avec l’eau |
| Solubilité | Insoluble dans les solvants organiques |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers du peroxyde de potassium
Le K2O2 présente plusieurs risques pour la sécurité en raison de ses fortes propriétés oxydantes. Il peut réagir vigoureusement avec l’eau ou l’humidité, libérant de l’oxygène gazeux et générant de la chaleur. Cette réaction peut potentiellement provoquer un incendie ou une explosion si elle n’est pas manipulée correctement. De plus, il peut provoquer une irritation de la peau et des yeux au contact, et l’inhalation de ses poussières peut provoquer des problèmes respiratoires. Il est important de manipuler le K2O2 avec précaution, en portant un équipement de protection individuelle approprié et en le stockant dans un endroit frais et sec, à l’écart des sources de chaleur et des matériaux incompatibles. En cas d’exposition accidentelle, consulter immédiatement un médecin.
| Symboles de danger | Agent d’oxydation |
| Description de la sécurité | Ne pas exposer à l’eau. Porter des gants de protection et une protection pour les yeux/le visage. Conserver dans un endroit frais et sec, à l’écart des sources de chaleur et des matières incompatibles. |
| Numéros d’identification de l’ONU | UN1504 |
| Code SH | 2829.90.90 |
| Classe de danger | 5.1 |
| Groupe d’emballage | II |
| Toxicité | Peut provoquer une irritation de la peau et des yeux. L’inhalation de poussière peut provoquer des problèmes respiratoires. |
Méthodes de synthèse du peroxyde de potassium
Il existe plusieurs méthodes pour synthétiser le K2O2, notamment la réaction de l’hydroxyde de potassium avec le peroxyde d’hydrogène , la réaction de l’hydroxyde de potassium avec le peroxyde de baryum et la décomposition thermique du superoxyde de potassium.
La première méthode consiste à ajouter lentement de l’hydroxyde de potassium à une solution de peroxyde d’hydrogène tout en remuant jusqu’à ce qu’elle forme un précipité blanc de K2O2. Le processus consiste à filtrer le mélange et à laver le solide à l’eau froide pour éliminer les impuretés.
Dans la deuxième méthode, agitez une suspension de peroxyde de baryum tout en ajoutant une solution d’ hydroxyde de potassium . Filtrer le mélange et évaporer à sec le filtrat. Chauffez ensuite le solide obtenu à haute température pour décomposer tout peroxyde de baryum restant et former du K2O2.
La troisième méthode consiste à chauffer le superoxyde de potassium à une température élevée, ce qui entraîne sa décomposition en K2O2 et en oxygène gazeux.
Utilisations du peroxyde de potassium
Le K2O2 a plusieurs utilisations dans diverses industries en raison de ses propriétés oxydantes. Certaines de ses utilisations incluent :
- Agent de blanchiment : utilisé comme agent de blanchiment pour les textiles et les produits en papier, ainsi que pour les produits de blanchiment des cheveux et des dents.
- Source d’oxygène : utilisée comme source d’oxygène dans des systèmes fermés, comme dans les sous-marins, où elle peut libérer de l’oxygène lorsqu’elle est mélangée à de l’eau.
- Polymérisation : Utilisé dans la polymérisation de certains monomères pour produire des polymères, comme dans la synthèse du polystyrène.
- Assainissement des sols : utilisé pour l’assainissement des sols afin d’éliminer les contaminants organiques, tels que les déversements de pétrole.
- Chimie analytique : Utilisé en chimie analytique comme agent oxydant pour déterminer la présence de certains composés.
- Carburant de fusée : utilisé comme comburant dans le carburant de fusée en raison de sa capacité à libérer de l’oxygène.
- Synthèse chimique : Utilisé dans la synthèse de divers composés organiques et inorganiques, comme la synthèse du permanganate de potassium.
Des questions:
Q : Quel est le meilleur, le peroxyde d’hydrogène ou l’hydroxyde de potassium ?
R : Cela dépend de l’utilisation prévue. Le peroxyde d’hydrogène est un puissant agent oxydant et est couramment utilisé comme désinfectant, agent de blanchiment et blanchisseur de cheveux et de dents. L’hydroxyde de potassium, quant à lui, est une base forte et est couramment utilisé dans la production de savons et de détergents, ainsi que dans la production de biodiesel à partir d’huiles végétales.
Q : Quelles sont les formules chimiques du superoxyde de potassium, du peroxyde de potassium et de l’oxyde de potassium ?
R : Les formules chimiques sont K2O2 pour le superoxyde de potassium, K2O2 pour le peroxyde de potassium et K2O pour l’oxyde de potassium.
Q : Que se forme lorsque le peroxyde d’hydrogène réagit avec l’iodure de potassium et l’iodate ?
R : Lorsque le peroxyde d’hydrogène réagit avec l’iodure de potassium et l’iodate, l’iode est produit selon la réaction suivante : H2O2 + KI + KIO3 → I2 + K2O + H2O.
Q : Quel est le nombre d’oxydation de l’atome d’oxygène dans le K2O2 ?
R : Le nombre d’oxydation de l’atome d’oxygène dans K2O2 est -1.
Q : Quel est le nombre d’oxydation du K dans le K2O2 ?
R : Le nombre d’oxydation du K dans le K2O2 est de +1.
