Le permanganate de potassium (KMnO4) est un composé cristallin violet utilisé à diverses fins, telles que la désinfection de l’eau, le traitement des affections cutanées et comme réactif de laboratoire. Il peut également être utilisé comme un puissant agent oxydant.
| Nom UICPA | Le permanganate de potassium |
| Formule moléculaire | KMnO4 |
| Numero CAS | 7722-64-7 |
| Synonymes | Permanganate de potasse, cristaux de Condy, minéral caméléon, hypermangane, Kalium hypermanganicum |
| InChI | InChI=1S/K.Mn.4O/q+1;;;;-1 |
Propriétés du permanganate de potassium
Formule de permanganate de potassium
La formule chimique du permanganate de potassium est KMnO4. Il se compose d’un ion potassium (K+), d’un ion manganèse (MnO4^-) et de quatre atomes d’oxygène (O). La formule indique le type et le nombre d’atomes qui composent le composé. Il est utilisé pour écrire des équations chimiques et pour calculer la masse et le nombre d’atomes présents dans une quantité donnée de substance.
Permanganate De Potassium Masse molaire
KMnO4 a une masse molaire de 158,034 g/mol. Cela signifie qu’une mole de KMnO4, qui équivaut à 6,022 x 10^23 molécules, a une masse de 158,034 grammes. La masse molaire d’un composé est calculée en additionnant les masses atomiques de tous les éléments présents dans le composé. Dans le cas du KMnO4, la masse molaire est calculée en additionnant les masses atomiques du potassium, du manganèse et de l’oxygène.
Point d’ébullition du permanganate de potassium
Le KMnO4 n’a pas de point d’ébullition défini car il se décompose avant d’atteindre son point d’ébullition. À pression atmosphérique, KMnO4 commence à se décomposer vers 240°C. Lorsqu’il est chauffé, il libère d’abord de l’oxygène et forme du manganate de potassium, qui se décompose ensuite en oxyde de potassium et en oxyde de manganèse.
Permanganate de Potassium Point de fusion
KMnO4 a un point de fusion élevé de 240°C. Cela signifie qu’à des températures inférieures à 240°C, KMnO4 existera à l’état solide. Lorsqu’il est chauffé, le KMnO4 subit une série de modifications chimiques, notamment la libération d’oxygène et la formation de différents oxydes de manganèse.
Densité du permanganate de potassium g/ml
La densité du KMnO4 est de 2,703 g/mL à température ambiante. Cela signifie qu’un millilitre de KMnO4 pèse 2,703 grammes. La densité d’une substance est le rapport de sa masse à son volume. Dans le cas du KMnO4, sa haute densité le rend utile pour le séparer des autres substances par filtration.
Permanganate De Potassium Poids moléculaire
Le poids moléculaire du KMnO4 est de 158,034 g/mol. Cette valeur représente la masse moyenne d’une molécule de KMnO4. Il est calculé en additionnant les masses atomiques de potassium, de manganèse et d’oxygène qui composent le composé.
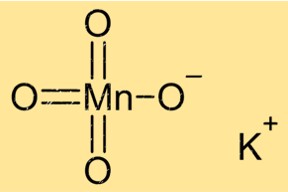
Structure du permanganate de potassium
KMnO4 a une structure cristalline avec un système cristallin monoclinique. Ses cristaux sont de couleur violette et ont une forme prismatique. Le composé a une géométrie de coordination octaédrique, avec six atomes d’oxygène entourant l’atome central de manganèse. Les ions potassium sont situés entre les couches d’atomes de manganèse et d’oxygène.
| Apparence | Solide cristallin violet foncé |
| Gravité spécifique | 2,703 g/cm³ |
| Couleur | Violet foncé |
| Odeur | Inodore |
| Masse molaire | 158,034 g/mole |
| Densité | 2,703 g/cm³ |
| Point de fusion | 240°C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 6,38 g/L à 20°C |
| Solubilité | Soluble dans l’eau, l’éthanol, l’acétone |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 2.17 |
| pH | 7,2 – 8,9 (solution à 1 %) |
Sécurité et dangers du permanganate de potassium
Le KMnO4 peut être dangereux s’il n’est pas manipulé correctement. C’est un agent oxydant puissant qui peut réagir violemment avec les agents réducteurs, les composés organiques et d’autres produits chimiques. Il peut provoquer une irritation de la peau et des yeux et peut être nocif en cas d’ingestion ou d’inhalation. Le composé peut également tacher la peau et les vêtements. Des précautions de sécurité appropriées doivent être prises lors de la manipulation du KMnO4, notamment le port de vêtements de protection, de lunettes et de gants. Il doit être stocké dans un endroit frais, sec et bien ventilé, à l’écart des matériaux incompatibles. En cas d’exposition ou d’ingestion, consulter immédiatement un médecin.
| Symboles de danger | O, Xn |
| Description de la sécurité | S22, S26, S36/37/39, S45 |
| Numéros d’identification de l’ONU | ONU 1490 |
| Code SH | 28416100 |
| Classe de danger | 5.1 |
| Groupe d’emballage | II |
| Toxicité | Toxique en cas d’ingestion ou d’inhalation. Peut provoquer une irritation de la peau et des yeux. |
Méthodes de synthèse du permanganate de potassium
Diverses méthodes peuvent synthétiser le KMnO4.
Une méthode consiste à faire réagir le dioxyde de manganèse avec de l’hydroxyde de potassium et un agent oxydant, tel que le chlore ou le peroxyde d’hydrogène.
Une autre méthode consiste à faire réagir du manganate de potassium avec du chlore gazeux.
Encore une autre méthode consiste à faire réagir de l’hydroxyde de potassium avec du dioxyde de manganèse, puis à oxyder le mélange résultant avec un agent oxydant.
Le processus de synthèse consiste généralement à chauffer les réactifs à une température spécifique et à maintenir la température pendant un certain temps. Le processus consiste à filtrer le mélange obtenu et à obtenir du KMnO4 par cristallisation.
Utilisations du permanganate de potassium
Le KMnO4 a diverses utilisations dans plusieurs industries en raison de ses fortes propriétés oxydantes. Voici quelques utilisations courantes du KMnO4 :
- Traitement de l’eau : Utilisé pour traiter l’eau à des fins municipales et industrielles, car il peut éliminer les impuretés et éliminer les odeurs désagréables.
- Applications médicales : utilisé localement pour traiter les affections cutanées (eczéma, dermatite et infections fongiques).
- Utilisation en laboratoire : Utilisé comme agent oxydant dans diverses expériences de laboratoire et comme colorant en biologie pour mettre en évidence les cellules et les tissus.
- Agriculture : Utilisé comme fongicide et bactéricide pour protéger les cultures contre les ravageurs et les maladies nuisibles.
- Chimie : Utilisé en chimie analytique pour déterminer la concentration de certains produits chimiques et en chimie organique comme réactif dans des réactions chimiques.
- Lutte contre les incendies : Utilisé comme ignifuge et pour éteindre certains types d’incendies.
- Applications industrielles : Utilisé dans la production de produits chimiques, de textiles et de batteries.
Des questions:
Q : Quel gaz est libéré lorsque le permanganate de potassium est décomposé ?
R : Lorsque le KMnO4 est décomposé, de l’oxygène gazeux (O2) est libéré.
Q : Qu’est-ce que le permanganate de potassium ?
R : Le permanganate de potassium est un agent oxydant puissant de formule chimique KMnO4.
Q : Quelle est la formule chimique du permanganate de potassium ?
R : La formule chimique du permanganate de potassium est KMnO4.
Q : Où acheter des cristaux de permanganate de potassium ?
R : Les cristaux de KMnO4 peuvent être achetés auprès de fournisseurs de produits chimiques, d’entreprises de fournitures de laboratoire et de détaillants en ligne.
Q : Qu’est-ce que le KMnO4 ?
R : KMnO4 est la formule chimique du permanganate de potassium.
Q : Quel est l’indice d’oxydation du manganèse dans KMnO4 ?
R : Le nombre d’oxydation du manganèse dans KMnO4 est de +7.
Q : Quel est le nombre d’oxydation de l’oxygène dans KMnO4 ?
R : Le nombre d’oxydation de l’oxygène dans KMnO4 est de -2.
Q : Combien de moles y a-t-il dans 25,0 grammes de KMnO4 ?
R : Pour calculer le nombre de moles dans 25,0 grammes de KMnO4, nous devons diviser la masse donnée par la masse molaire de KMnO4. La masse molaire de KMnO4 est de 158,034 g/mol. Par conséquent, il y a environ 0,158 mole de KMnO4 dans 25,0 grammes.
