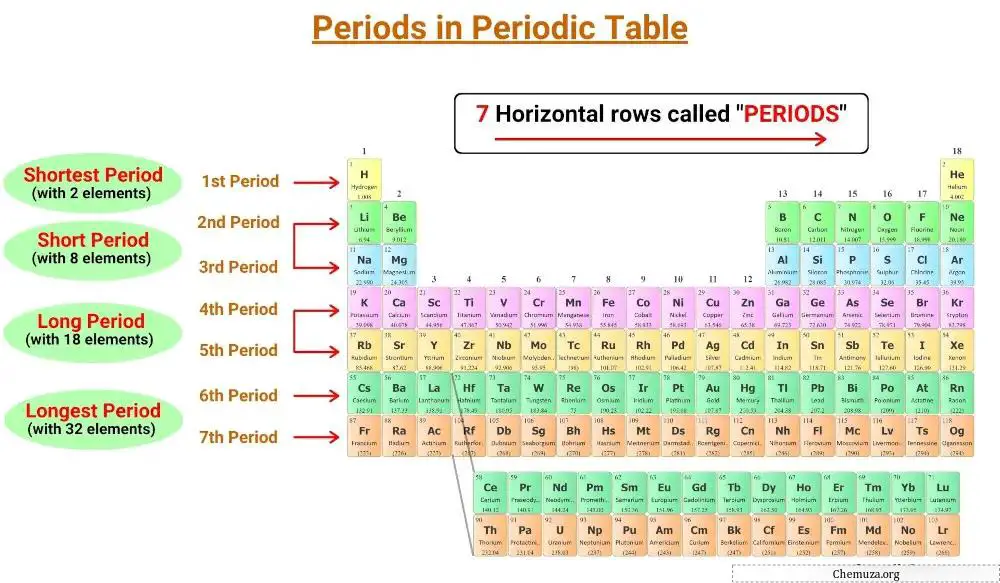
Les lignes horizontales du tableau périodique sont appelées périodes et il y a 7 périodes dans le tableau périodique.
Les éléments situés dans la même période ont le même nombre de couches électroniques.
Explorons davantage les périodes du tableau périodique.
Que sont les périodes dans le tableau périodique ?
Dans le tableau périodique, les points sont les lignes qui s’étendent horizontalement de gauche à droite.
Le tableau périodique est organisé de manière à ce que les éléments ayant des propriétés similaires soient regroupés dans des colonnes appelées groupes ou familles, tandis que les éléments d’une même période ont le même nombre de couches électroniques.
Il y a sept périodes dans le tableau périodique, numérotées de 1 à 7. [1]
Nombre de coques d’un élément et son numéro de période
Le nombre de coquilles d’un élément détermine sa période dans le tableau périodique.
Par exemple, les éléments de la période 1 n’ont qu’une seule couche électronique, tandis que les éléments de la période 2 ont deux couches électroniques, et ainsi de suite.
Cette organisation aide les chimistes à prédire les propriétés d’un élément en fonction de son emplacement dans le tableau périodique.
Caractéristiques des éléments dans les périodes
Au fur et à mesure que vous vous déplacez dans une période du tableau périodique, plusieurs caractéristiques des éléments changent de manière prévisible. Cela est dû aux tendances périodiques observées dans les propriétés des éléments.
Rayon atomique :
À mesure que vous vous déplacez de gauche à droite sur une période, le rayon atomique diminue généralement. [2]
En effet, le nombre de protons dans le noyau augmente, provoquant une plus grande attraction entre le noyau et les électrons au niveau d’énergie le plus externe. Cela se traduit par un rayon atomique plus petit.
Électronégativité :
L’électronégativité est la mesure de la capacité d’un atome à attirer des électrons vers lui dans une liaison chimique.
À mesure que vous vous déplacez de gauche à droite sur une période, l’électronégativité augmente généralement. [3]
En effet, le rayon atomique est plus petit et la charge positive du noyau est plus forte, ce qui le rend plus attractif pour les électrons chargés négativement.
Énergie d’ionisation:
L’énergie d’ionisation est la quantité d’énergie nécessaire pour retirer un électron d’un atome.
À mesure que vous vous déplacez de gauche à droite sur une période, l’énergie d’ionisation augmente généralement. [4]
En effet, le rayon atomique est plus petit et les électrons sont retenus plus étroitement par le noyau, ce qui rend plus difficile l’élimination d’un électron.
Autres caractéristiques:
Points de fusion et d’ébullition : augmentent généralement de gauche à droite au cours d’une période, mais à quelques exceptions près.
Caractère métallique : diminue de gauche à droite au cours d’une période, à mesure que les non-métaux deviennent plus répandus.
Réactivité : les éléments deviennent moins réactifs à mesure que vous vous déplacez de gauche à droite au cours d’une période, car les électrons sont retenus plus étroitement et sont moins susceptibles de participer aux réactions chimiques.
Importance des périodes en chimie
Les périodes du tableau périodique sont essentielles à la compréhension du comportement des éléments, car elles fournissent des informations sur la configuration électronique des éléments et sur la manière dont ils interagissent avec d’autres éléments. Voici quelques raisons pour lesquelles les périodes sont importantes en chimie :
- Prédire les propriétés : le tableau périodique permet aux scientifiques de prédire les propriétés des éléments en fonction de leur position dans le tableau. Par exemple, les éléments d’une même période ont le même nombre de couches électroniques, ce qui peut aider à prédire leur taille atomique, leur réactivité et d’autres propriétés.
- Identifier les tendances : La disposition des éléments dans le tableau périodique permet aux scientifiques d’identifier les tendances de leurs propriétés. Par exemple, l’électronégativité et l’énergie d’ionisation ont tendance à augmenter de gauche à droite sur une période, tandis que la taille atomique a tendance à diminuer. Ces informations peuvent être utilisées pour faire des prédictions sur le comportement des éléments dans les réactions chimiques.
- Regroupement d’éléments : le tableau périodique regroupe les éléments en catégories en fonction de leurs propriétés, telles que les métaux, les non-métaux et les métalloïdes . Cela aide les scientifiques à comprendre les similitudes et les différences entre les éléments et la manière dont ils interagissent les uns avec les autres.
- Découvrir de nouveaux éléments : Le tableau périodique aide également les scientifiques à prédire l’existence et les propriétés de nouveaux éléments. En examinant les lacunes du tableau, les scientifiques peuvent prédire les propriétés d’éléments non découverts et les rechercher en laboratoire.
Résumé
Le tableau périodique comporte sept lignes horizontales appelées périodes. Les éléments d’une même période ont le même nombre de couches électroniques. Il y a sept périodes dans le tableau périodique, numérotées de 1 à 7, et le nombre de coquilles d’un élément détermine sa période.
À mesure que vous parcourez une période du tableau périodique, le rayon atomique diminue généralement, tandis que l’électronégativité et l’énergie d’ionisation augmentent généralement. D’autres caractéristiques telles que les points de fusion et d’ébullition, le caractère métallique et la réactivité changent également de manière prévisible au cours d’une période.
Les périodes du tableau périodique sont importantes pour prédire les propriétés des éléments, identifier les tendances, regrouper les éléments et découvrir de nouveaux éléments. En examinant les lacunes du tableau, les scientifiques peuvent prédire les propriétés d’éléments non découverts et les rechercher en laboratoire.
