Le perchlorate de sodium est un composé chimique de formule NaClO4. Il s’agit d’un solide cristallin blanc hautement soluble dans l’eau et couramment utilisé comme agent oxydant dans divers processus industriels.
| Nom UICPA | Perchlorate de sodium |
| Formule moléculaire | NaClO4 |
| Numero CAS | 7601-89-0 |
| Synonymes | Acide perchlorique, sel de sodium ; Perchlorate de sodium (français); Perchlorate de sodium (allemand); Perclorato di sodio (italien); Perclorato sódico (espagnol); ONU 1502 |
| InChI | InChI=1S/ClHO4.Na/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
Propriétés du perchlorate de sodium
Formule au perchlorate de sodium
La formule chimique du perchlorate de sodium est NaClO4. Cela signifie que le composé est composé d’un atome de sodium, d’un atome de chlore et de quatre atomes d’oxygène. Le perchlorate de sodium est un agent oxydant puissant couramment utilisé dans divers procédés industriels.
Perchlorate De Sodium Masse molaire
La masse molaire de NaClO4 est de 122,44 g/mol. Cela signifie qu’une mole de NaClO4 contient 122,44 grammes du composé. La masse molaire d’un composé est importante pour déterminer la quantité de substance nécessaire à une réaction chimique.
Point d’ébullition du perchlorate de sodium
Le point d’ébullition de NaClO4 est de 545 °C (1 013 hPa). C’est la température à laquelle le composé passe de l’état liquide à l’état gazeux. NaClO4 a un point d’ébullition élevé en raison des fortes forces électrostatiques entre les ions sodium et perchlorate.
Perchlorate de sodium Point de fusion
Le point de fusion de NaClO4 est de 482 °C. C’est la température à laquelle le composé passe de l’état solide à l’état liquide. NaClO4 a un point de fusion élevé en raison des fortes forces électrostatiques entre les ions sodium et perchlorate.
Densité du perchlorate de sodium g/mL
La densité de NaClO4 est de 2,52 g/mL. Cela signifie qu’un millilitre de NaClO4 pèse 2,52 grammes. La densité d’une substance est importante pour déterminer ses propriétés physiques, telles que la flottabilité et la viscosité.
Perchlorate De Sodium Poids moléculaire
Le poids moléculaire de NaClO4 est de 122,44 g/mol. Il s’agit de la somme des poids atomiques des atomes de sodium, de chlore et d’oxygène du composé. Le poids moléculaire d’un composé est important pour déterminer ses propriétés physiques et chimiques.
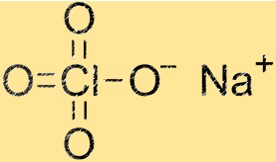
Structure du perchlorate de sodium
La structure de NaClO4 est un réseau cristallin composé de cations Na+ et d’anions ClO4-. Les cations sodium sont entourés de quatre atomes d’oxygène, tandis que les anions ClO4- sont constitués d’un atome de chlore et de quatre atomes d’oxygène. La structure du réseau cristallin confère au NaClO4 ses propriétés physiques et chimiques caractéristiques.
Solubilité du perchlorate de sodium
NaClO4 est hautement soluble dans l’eau, avec une solubilité de 209 g/100 mL à 20 °C. Cela signifie qu’une grande quantité de NaClO4 peut se dissoudre dans une petite quantité d’eau. La haute solubilité du NaClO4 le rend utile dans divers processus industriels, tels que la production de perchlorate d’ammonium pour le carburant des fusées.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2,52 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 122,44 g/mole |
| Densité | 2,52 g/ml |
| Point de fusion | 482 °C |
| Point d’ébullition | 545 °C (1 013 hPa) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 209 g/100 mL à 20°C |
| Solubilité | Soluble dans l’eau et l’éthanol |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Pas disponible |
Sécurité et dangers du perchlorate de sodium
NaClO4 est un composé dangereux qui doit être manipulé avec précaution. C’est un agent oxydant puissant qui peut réagir violemment avec les matières organiques, les agents réducteurs et d’autres produits chimiques. L’exposition à la poussière ou aux vapeurs de NaClO4 peut provoquer une irritation des yeux, de la peau et du système respiratoire. L’ingestion de NaClO4 peut provoquer une irritation gastro-intestinale, des nausées et des vomissements. NaClO4 est également nocif pour la vie aquatique et doit être éliminé correctement. Des équipements de protection individuelle tels que des gants, des lunettes et un respirateur doivent être portés lors de la manipulation de NaClO4 pour éviter toute exposition. Une ventilation et un stockage adéquats sont également importants pour minimiser les risques d’accidents.
| Symboles de danger | O, Xn |
| Description de la sécurité | Ne pas respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. EN CAS D’INHALATION : Amener la victime à l’air frais et la maintenir au repos dans une position confortable pour respirer. EN CAS D’INGESTION : Rincer la bouche. NE PAS faire vomir. Appelez un CENTRE ANTIPOISON ou un médecin si vous ne vous sentez pas bien. |
| Numéros d’identification de l’ONU | UN1502 |
| Code SH | 2829.90.90 |
| Classe de danger | 5.1 |
| Groupe d’emballage | II |
| Toxicité | Toxique en cas d’ingestion, nocif par inhalation ou par contact avec la peau. Peut provoquer une irritation ou une corrosion. |
Méthodes de synthèse du perchlorate de sodium
Diverses méthodes peuvent synthétiser NaClO4.
Une méthode courante implique la réaction du chlorate de sodium avec l’acide chlorhydrique , entraînant la formation de NaClO4 et de chlorure de sodium .
Une autre méthode implique l’électrolyse d’une solution de chlorure de sodium en présence d’un sel perchlorate. La conversion du chlorure de sodium en chlorate de sodium se produit, suivie de l’ajout d’acide chlorhydrique, qui le convertit en NaClO4.
Une autre approche consiste à faire réagir le chlorate de sodium avec le chlorure de sodium en présence d’acide sulfurique. Cette méthode produit un mélange de NaClO4 et de sulfate de sodium, qui peut être séparé par cristallisation fractionnée.
Une autre méthode implique la réaction du chlorate de sodium avec le perchlorate d’ammonium, qui produit du NaClO4 et du chlorure d’ammonium. La production de NaClO4, couramment utilisé comme oxydant dans les propergols solides des fusées, implique l’utilisation de cette méthode.
La réaction de l’hypochlorite de sodium avec le chlorate de sodium en présence d’acide chlorhydrique synthétise également NaClO4. Cette méthode produit du NaClO4 et du chlorure de sodium comme principaux produits.
Utilisations du perchlorate de sodium
NaClO4 a diverses utilisations dans différentes industries. Voici quelques applications courantes du NaClO4 :
- Propulseurs de fusée : Couramment utilisés comme oxydants dans les propulseurs de fusées solides en raison de leur teneur élevée en oxygène et de leur grande stabilité.
- Pyrotechnie : utilisé comme oxydant dans les compositions pyrotechniques telles que les fusées éclairantes, les feux d’artifice et les fusées éclairantes.
- Chimie analytique : utilisée comme source d’ions perchlorate en chimie analytique pour la détermination des ions dans divers échantillons.
- Galvanoplastie : Utilisé comme composant dans les solutions de galvanoplastie pour améliorer la conductivité et la stabilité du bain de placage.
- Batteries : Utilisé comme électrolyte dans les batteries lithium-ion, en raison de sa haute solubilité et de sa capacité à améliorer les propriétés électrochimiques de la batterie.
- Applications médicales : Utilisé dans le traitement des troubles thyroïdiens comme inhibiteur compétitif du transport de l’iode. Également utilisé dans la production d’agents de contraste pour l’imagerie médicale.
- Traitement de l’eau : Utilisé dans le traitement de l’eau comme désinfectant et pour éliminer certains contaminants de l’eau.
Des questions:
Q : Quelle est la formule du perchlorate de sodium ?
R : NaClO4.
Q : Le perchlorate de sodium est-il soluble dans l’eau ?
R : Oui, NaClO4 est hautement soluble dans l’eau.
Q : Le perchlorate de sodium est-il un acide ou une base ?
R : NaClO4 n’est ni un acide ni une base. C’est du sel.
Q : Quelle est la réaction du perchlorate d’ammonium et du bromure de sodium ?
R : La réaction est : NH4ClO4 + NaBr → NaClO4 + NH4Br.
Q : Combien d’ions sodium y a-t-il dans le perchlorate de sodium ?
R : Il y a un ion sodium dans NaClO4.
Q : NaClO4 est-il un acide ou une base ?
R : NaClO4 n’est ni un acide ni une base. C’est un sel.
Q : Quelles espèces dissoutes sont présentes dans une solution de NaClO4 ?
R : Dans une solution de NaClO4, les espèces dissoutes sont les ions Na+ et ClO4-.
Q : Combien de moles d’oxygène y a-t-il dans 3,30 moles de NaClO4 ?
R : Il y a 13,2 moles d’oxygène dans 3,30 moles de NaClO4.
Q : Le NaClO4 est-il soluble dans l’eau ?
R : Oui, NaClO4 est hautement soluble dans l’eau.
Q : Combien de moles d’oxygène y a-t-il dans 1,10 mole de NaClO4 ?
R : Il y a 4,4 moles d’oxygène dans 1,10 moles de NaClO4.
