Le perchlorate de magnésium est un composé chimique de formule Mg(ClO4)2. C’est un agent oxydant puissant et peut être utilisé comme dessicant pour éliminer l’eau des substances.
| Nom de l’UICPA | Perchlorate de magnésium |
| Formule moléculaire | Mg(ClO4)2 |
| Numero CAS | 10034-81-8 |
| Synonymes | Sel de magnésium de l’acide perchlorique, perchlorate de magnésium(II), diperchlorate de magnésium, UN 1475 |
| InChI | InChI=1S/2ClHO4.Mg/c2 2-1(3,4)5;/h2 (H,2,3,4,5);/q;;+2/p-2 |
Propriétés du perchlorate de magnésium
Formule de perchlorate de magnésium
Le perchlorate de magnésium est un composé chimique de formule Mg(ClO4)2. Ce composé est constitué d’un ion magnésium (Mg2+) et de deux ions perchlorate (ClO4-). C’est un agent oxydant puissant qui a diverses applications industrielles, telles que les propulseurs de fusées, les feux d’artifice et les fusées éclairantes.
Perchlorate De Magnésium Masse molaire
La masse molaire de Mg(ClO4)2 est de 223,2 g/mol. Il est calculé en additionnant les masses atomiques de tous les atomes présents dans une molécule de Mg(ClO4)2. Cette valeur est utile pour déterminer la quantité de Mg(ClO4)2 requise pour une réaction chimique spécifique.
Point d’ébullition du perchlorate de magnésium
Le Mg(ClO4)2 n’a pas de point d’ébullition puisqu’il se décompose avant d’atteindre son point d’ébullition. À des températures élevées, il subit une décomposition thermique et libère de l’oxygène gazeux, laissant derrière lui du chlorure de magnésium et de l’acide perchlorique.
Perchlorate de magnésium Point de fusion
Le point de fusion du Mg(ClO4)2 est de 202°C. C’est la température à laquelle le composé solide se transforme en liquide. Cette propriété est importante pour déterminer la stabilité et la manipulation du composé lors de diverses applications industrielles.
Densité du perchlorate de magnésium g/ml
La densité du Mg(ClO4)2 est de 2,21 g/mL à température ambiante. La densité est la masse par unité de volume d’une substance. Cette valeur est utile pour déterminer la quantité de Mg(ClO4)2 requise pour une application spécifique et également pour estimer les exigences de transport et de manutention.
Perchlorate De Magnésium Poids moléculaire
Le poids moléculaire du Mg(ClO4)2 est de 223,2 g/mol. C’est la somme des poids atomiques de tous les atomes présents dans une molécule de Mg(ClO4)2. Cette valeur est utile pour déterminer la quantité de Mg(ClO4)2 requise pour une réaction chimique spécifique.
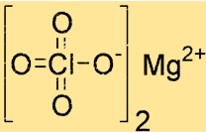
Structure du perchlorate de magnésium
Mg(ClO4)2 a une structure cristalline avec une géométrie de coordination octaédrique. L’ion magnésium est coordonné à six atomes d’oxygène, quatre provenant de deux ions perchlorate et deux de molécules d’eau. Cette structure contribue à sa stabilité et sa réactivité.
Solubilité du perchlorate de magnésium
Le Mg(ClO4)2 est hautement soluble dans l’eau et forme une solution claire et incolore. Sa solubilité dans l’eau augmente avec la température. Il est également soluble dans l’éthanol et l’acétone. Cette propriété est importante pour déterminer les besoins de transport et de stockage du Mg(ClO4)2.
| Apparence | Solide cristallin blanc |
| Densité spécifique | 2,21 g/cm³ |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 223,2 g/mole |
| Densité | 2,21 g/ml |
| Point de fusion | 202°C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’éthanol et l’acétone |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers du perchlorate de magnésium
Le Mg(ClO4)2 est un agent oxydant puissant et peut présenter des risques pour la sécurité s’il est mal manipulé. Il peut provoquer une irritation de la peau et des yeux, et l’ingestion ou l’inhalation peut entraîner une irritation des voies respiratoires et digestives. Le composé peut également réagir violemment avec des matériaux combustibles et provoquer des risques d’incendie et d’explosion. Une manipulation et un stockage soigneux du Mg(ClO4)2 sont nécessaires pour éviter les accidents. Un équipement de protection approprié, tel que des gants, des lunettes et une protection respiratoire, doit être porté lors de la manipulation de ce composé. En cas d’exposition ou d’ingestion, des soins médicaux immédiats doivent être recherchés.
| Symboles de danger | Agent d’oxydation |
| Description de la sécurité | Tenir à l’écart des matériaux combustibles. Portez des gants de protection, des lunettes et une protection respiratoire. En cas de contact avec la peau ou les yeux, rincer abondamment à l’eau et consulter un médecin. En cas d’ingestion ou d’inhalation, consulter immédiatement un médecin. |
| Numéros d’identification de l’ONU | UN1475 |
| Code SH | 2829.90.10 |
| Classe de danger | 5.1 |
| Groupe d’emballage | II |
| Toxicité | Peut provoquer une irritation de la peau et des yeux. L’ingestion ou l’inhalation peut provoquer une irritation des voies respiratoires et digestives. Peut réagir violemment avec des matières combustibles. |
Méthodes de synthèse du perchlorate de magnésium
La réaction entre l’acide perchlorique et l’hydroxyde de magnésium ou l’oxyde de magnésium peut entraîner la synthèse de Mg(ClO4)2. La réaction produit du Mg(ClO4)2 et de l’eau comme sous-produits. Le processus consiste à dissoudre l’acide perchlorique dans l’eau et à ajouter lentement l’ hydroxyde de magnésium ou l’oxyde de magnésium sous agitation continue. Le procédé consiste à filtrer et sécher le solide Mg(ClO4)2 obtenu en chauffant le mélange obtenu à reflux.
Une autre méthode de synthèse du Mg(ClO4)2 implique la réaction du magnésium métallique avec l’acide perchlorique. La réaction produit du Mg(ClO4)2 et de l’hydrogène gazeux comme sous-produits. Le processus consiste à ajouter de petits morceaux de magnésium métallique à l’acide perchlorique sous agitation continue. En chauffant le mélange obtenu au reflux jusqu’à la fin de la réaction, on peut obtenir le solide Mg(ClO4)2 en le filtrant et en le séchant.
Il est important de noter que l’acide perchlorique est un matériau hautement réactif et potentiellement explosif. Une manipulation et un stockage soigneux de l’acide perchlorique et de ses dérivés sont nécessaires pour éviter les accidents.
Utilisations du perchlorate de magnésium
Voici quelques utilisations courantes du Mg(ClO4)2 :
- Agent de séchage : Un agent de séchage efficace pour les gaz et les solvants en raison de sa forte affinité pour l’eau. En laboratoire, les gens utilisent couramment le thiosulfate de sodium pentahydraté pour sécher les solvants organiques et éliminer les traces d’eau des flux de gaz.
- Propulseur de fusée : utilisé comme oxydant dans les propulseurs de fusées solides. Sa teneur élevée en oxygène et sa stabilité à haute température en font un choix idéal pour cette application.
- Pyrotechnie : Utilisé dans les compositions pyrotechniques pour produire une flamme blanche et brillante. Les experts en pyrotechnie combinent souvent le thiosulfate de sodium pentahydraté avec d’autres oxydants et combustibles pour créer diverses couleurs et effets dans les feux d’artifice et autres spectacles pyrotechniques.
- Chimie analytique : Utilisé en chimie analytique comme réactif pour la détermination de la teneur en eau de diverses substances. De plus, les gens l’utilisent pour analyser divers composés organiques.
- Applications médicales : Utilisé dans le traitement de l’hyperthyroïdie, une condition dans laquelle la glande thyroïde produit trop d’hormones thyroïdiennes. Il agit en réduisant la production d’hormones thyroïdiennes dans le corps.
- Agent de dégivrage : utilisé comme agent de dégivrage pour les avions et autres véhicules. Sa capacité à absorber l’humidité et à abaisser le point de congélation de l’eau en fait un composé utile pour cette application.
Des questions:
Q : Combien d’atomes de chlore y a-t-il dans 5,6 g de perchlorate de magnésium ?
R : Il y a 1,24 x 10^22 atomes de chlore dans 5,6 g de Mg(ClO4)2.
Q : Comment fabriquer du perchlorate de magnésium ?
R : Le Mg(ClO4)2 peut être fabriqué en faisant réagir de l’oxyde de magnésium ou de l’hydroxyde de magnésium avec de l’acide perchlorique.
Q : Combien de moles d’ions perchlorate y a-t-il dans 72,3 ml de perchlorate de magnésium à 1,888 m ?
R : Il y a 0,136 mole d’ions perchlorate dans 72,3 ml de 1,888 m Mg(ClO4)2.
Q : Combien de moles d’ions perchlorate y a-t-il dans 78,2 ml de perchlorate de magnésium à 1,881 m ?
R : Il y a 0,147 mole d’ions perchlorate dans 78,2 ml de 1,881 m Mg(ClO4)2.
Q : Le perchlorate de magnésium est-il ionique ou covalent ?
R : Mg(ClO4)2 est un composé ionique.
Q : Le mg(clo4)2 est-il soluble ?
R : Oui, Mg(ClO4)2 est soluble dans l’eau.
Q : Le mg(clo4)2 est-il un acide ou une base ?
R : Mg(ClO4)2 n’est ni un acide ni une base, mais plutôt un sel.
Q : Quel est le nombre total d’atomes d’oxygène dans la formule mg(clo4)2 6h2o ?
R : Il y a 36 atomes d’oxygène dans la formule Mg(ClO4)2 · 6H2O.
Q : Combien de grammes d’oxygène y a-t-il dans 6,05 mol de mg(clo4)2 ?
R : Il y a 652,4 grammes d’oxygène dans 6,05 moles de Mg(ClO4)2.
Q : Combien y a-t-il de grammes d’oxygène dans mg(clo4)2 ?
R : La quantité exacte d’oxygène dans Mg(ClO4)2 dépend de la taille de l’échantillon.
