Le perchlorate de calcium (Ca(ClO4)2) est un composé chimique qui a de nombreuses utilisations, notamment dans les feux d’artifice et les propulseurs de fusées. Il est très soluble dans l’eau et peut également être utilisé comme agent de séchage.
| Nom UICPA | Perchlorate de calcium |
| Formule moléculaire | Ca(ClO4)2 |
| Numero CAS | 13477-36-6 |
| Synonymes | Calciofos, sel de calcium de l’acide perchlorique, diperchlorate de calcium, perchlorate de calcium (II), UN1459 |
| InChI | InChI=1S/Ca.2ClHO4/c;2 2-1(3,4)5/h;2 (H,2,3,4,5)/q+2;;/p-2 |
Propriétés du perchlorate de calcium
Formule au perchlorate de calcium
La formule du perchlorate de calcium est Ca(ClO4)2. Il est composé d’un ion Ca2+ et de deux ions ClO4-. L’ion calcium a une charge positive de 2+ et chaque ion ClO4- a une charge négative de 1-. Cette formule est utilisée pour représenter la structure chimique du perchlorate de calcium.
Perchlorate De Calcium Masse molaire
La masse molaire de Ca(ClO4)2 est de 238,98 g/mol. Cette valeur représente la masse d’une mole de Ca(ClO4)2, qui contient le nombre de molécules d’Avogadro. La masse molaire est importante pour déterminer la quantité de Ca(ClO4)2 nécessaire dans une réaction particulière.
Point d’ébullition du perchlorate de calcium
Le Ca(ClO4)2 n’a pas de point d’ébullition car il se décompose avant d’atteindre son point d’ébullition. Lorsqu’il est chauffé, il se décompose en chlorure de calcium, en oxygène gazeux et en chlore gazeux. Cette réaction de décomposition est fortement exothermique, dégageant une quantité importante de chaleur.
Perchlorate de calcium Point de fusion
Le point de fusion du Ca(ClO4)2 est de 200°C. Cette température est le point auquel le Ca(ClO4)2 solide se transforme en état liquide. Le point de fusion est important pour déterminer les propriétés physiques du Ca(ClO4)2, telles que sa capacité à être utilisé comme agent de séchage.
Densité du perchlorate de calcium g/mL
La densité de Ca(ClO4)2 est de 2,505 g/mL. Cette valeur représente la quantité de masse par unité de volume de Ca(ClO4)2. La densité du Ca(ClO4)2 est supérieure à celle de l’eau, ce qui signifie qu’il coule dans l’eau.
Perchlorate De Calcium Poids moléculaire
Le poids moléculaire de Ca(ClO4)2 est de 238,98 g/mol. Cette valeur représente la somme des poids atomiques de tous les atomes d’une molécule de Ca(ClO4)2. Le poids moléculaire est important pour déterminer la quantité de Ca(ClO4)2 nécessaire dans une réaction particulière.
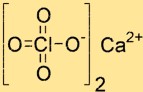
Structure du perchlorate de calcium
La structure de Ca(ClO4)2 est composée d’un ion Ca2+ et de deux ions ClO4-. L’ion Ca2+ est situé au centre de la structure et est entouré de quatre atomes d’oxygène provenant de deux ions ClO4-. Les ions ClO4- sont de forme tétraédrique et sont reliés à l’ion calcium par des atomes d’oxygène.
Solubilité du perchlorate de calcium
Le Ca(ClO4)2 est hautement soluble dans l’eau, avec une solubilité de 121 g/100 mL à 20°C. Cette solubilité le rend utile comme agent de séchage car il peut absorber l’eau de son environnement. Cependant, il est insoluble dans les solvants organiques tels que l’éthanol et l’acétone.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2,505 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 238,98 g/mole |
| Densité | 2,505 g/ml |
| Point de fusion | 200°C |
| Point d’ébullition | Se décompose avant le point d’ébullition |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 121 g/100 mL à 20°C |
| Solubilité | Insoluble dans les solvants organiques |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | N’est pas applicable |
Sécurité et dangers du perchlorate de calcium
Le Ca(ClO4)2 présente plusieurs risques pour la sécurité et des mesures de sécurité appropriées doivent être prises lors de sa manipulation. C’est un oxydant puissant qui peut réagir avec des matériaux inflammables, provoquant un incendie ou une explosion. L’inhalation de ses poussières ou de ses vapeurs peut provoquer une irritation des voies respiratoires et le contact avec la peau peut provoquer une irritation ou des brûlures. Il est également nocif en cas d’ingestion, provoquant une irritation ou une corrosion du tube digestif. Des équipements de protection individuelle adéquats, tels que des gants et des lunettes, doivent être portés lors de la manipulation du Ca(ClO4)2 et doivent être stockés à l’écart des matériaux inflammables et des substances incompatibles.
| Symboles de danger | Agent oxydant, nocif en cas d’ingestion |
| Description de la sécurité | Tenir à l’écart des matériaux inflammables et des substances incompatibles. Portez des gants et des lunettes de protection. Eviter l’inhalation de poussières ou de fumées. En cas de contact, laver abondamment à l’eau et consulter un médecin si nécessaire. |
| Numéros d’identification de l’ONU | UN1502 |
| Code SH | 2829.9000 |
| Classe de danger | 5.1 – Substances comburantes |
| Groupe d’emballage | II |
| Toxicité | Nocif en cas d’ingestion, irritant pour la peau et le système respiratoire |
Méthodes de synthèse du perchlorate de calcium
On peut synthétiser du Ca(ClO4)2 en faisant réagir de l’hydroxyde de calcium avec de l’acide perchlorique ou du perchlorate d’ammonium.
Une méthode implique la réaction du carbonate de calcium avec de l’acide perchlorique dans un récipient de réaction, suivie d’une filtration et d’une évaporation de la solution pour obtenir le produit solide.
Une autre méthode implique la réaction de l’oxyde de calcium avec une solution aqueuse d’acide perchlorique, suivie d’une filtration et d’un séchage du produit résultant.
Dans certains cas, on peut synthétiser du Ca(ClO4)2 en faisant réagir du chlorure de calcium avec du perchlorate de sodium dans un récipient de réaction. On peut filtrer et sécher le produit pour obtenir du Ca(ClO4)2 après la réaction.
Une autre méthode populaire pour synthétiser le Ca(ClO4)2 implique la réaction du chlorure de calcium avec le perchlorate d’ammonium, qui produit du Ca(ClO4)2 et du chlorure d’ammonium comme sous-produits. Les applications pyrotechniques préfèrent cette méthode en raison de sa capacité à produire du Ca(ClO4)2 de haute pureté.
Il est important de noter que lorsque vous travaillez avec de l’acide perchlorique, des mesures de sécurité appropriées doivent être prises, car il s’agit d’un agent oxydant puissant qui peut réagir avec des matières organiques, provoquant un incendie ou une explosion.
Utilisations du perchlorate de calcium
Le Ca(ClO4)2 a plusieurs utilisations dans diverses industries et applications. Certaines des utilisations du Ca(ClO4)2 sont :
- Pyrotechnie : Couramment utilisé en pyrotechnie comme agent oxydant en raison de sa teneur élevée en oxygène et de sa stabilité.
- Engrais : Utilisés dans les engrais pour fournir aux plantes du calcium et du chlore, qui sont des nutriments essentiels à leur croissance.
- Carburant de fusée : utilisé comme composant du carburant de fusée en raison de sa teneur élevée en oxygène et de sa stabilité.
- Raffinage du pétrole : utilisé dans l’industrie pétrolière pour éliminer les composés soufrés du pétrole brut et d’autres hydrocarbures.
- Gonfleurs d’airbags : Utilisés dans la fabrication de gonfleurs d’airbags en raison de leur capacité à se décomposer rapidement et à générer du gaz.
- Fusées lumineuses : Utilisées dans la fabrication de fusées éclairantes en raison de leur teneur élevée en oxygène et de leur stabilité.
- Traitement des surfaces métalliques : Utilisé dans le traitement des surfaces métalliques pour éliminer la rouille et autres impuretés.
- Applications en laboratoire : Utilisé dans diverses applications en laboratoire, telles que dans la préparation d’acide perchlorique et comme agent de séchage.
Des questions:
Q : Quelle est la formule du perchlorate de calcium ?
R : Ca(ClO4)2.
Q : Le perchlorate de calcium est-il ionique ou covalent ?
R : Ca(ClO4)2 est un composé ionique, car il est composé de cations calcium (Ca2+) et d’anions perchlorate (ClO4-).
Q : Comment éliminer le perchlorate de calcium ?
R : Le Ca(ClO4)2 peut être éliminé en lavant la zone affectée avec de l’eau, puis en neutralisant toute trace restante du composé avec une base faible, telle que le bicarbonate de sodium.
Q : Le perchlorate de calcium est-il soluble ?
R : Oui, Ca(ClO4)2 est soluble dans l’eau et d’autres solvants polaires. Sa solubilité dans l’eau est d’environ 120 g pour 100 mL d’eau à température ambiante.
Q : Quelles réactions produisent le perchlorate de calcium et l’eau ?
R : Le Ca(ClO4)2 et l’eau ne réagissent pas entre eux dans des conditions normales.
Q : Combien d’atomes de chlore y a-t-il dans 0,650 mole de Ca(ClO4)2 ?
R : Il y a 5,88 x 10^23 atomes de chlore dans 0,650 mole de Ca(ClO4)2.
Q : Quelle est la masse molaire de Ca(ClO4)2 ?
R : La masse molaire de Ca(ClO4)2 est de 238,98 g/mol.
Q : Quel est le coefficient d’activité de H dans une solution contenant 0,073 M de HCl et 0,0090 M de Ca(ClO4)2 ?
R : Le coefficient d’activité de H dans une solution contenant 0,073 M de HCl et 0,0090 M de Ca(ClO4)2 dépend de la température et d’autres facteurs. Elle peut être calculée à l’aide de modèles thermodynamiques et de données expérimentales.
Q : Combien de moles y a-t-il dans 26,0 grammes de Ca(ClO4)2 ?
R : Il y a 0,109 mole de Ca(ClO4)2 dans 26,0 grammes du composé.
