Le pentasulfure de phosphore (P2S5) est un composé composé de deux atomes de phosphore et de cinq atomes de soufre. Il est utilisé dans diverses applications, notamment la production d’insecticides et de lubrifiants.
| Nom UICPA | Pentasulfure de phosphore |
| Formule moléculaire | P2S5 |
| Numero CAS | 1314-80-3 |
| Synonymes | Sulfure de phosphore (V); Pentasulfure de diphosphore ; Sulfure phosphorique ; Phosphore pentasulfuré |
| InChI | InChI=1S/2P.5S |
Propriétés du pentasulfure de phosphore
Formule pentasulfure de phosphore
La formule du pentasulfure de phosphore est P2S5. Il est constitué de deux atomes de phosphore liés à cinq atomes de soufre.
Pentasulfure De Phosphore Masse molaire
La masse molaire du pentasulfure de diphosphore peut être calculée en additionnant les masses atomiques des éléments constitutifs. La masse atomique du phosphore (P) est d’environ 30,97 g/mol et celle du soufre (S) est d’environ 32,07 g/mol. La masse molaire du P2S5 est donc d’environ 222,27 g/mol.
Point d’ébullition du pentasulfure de phosphore
Le pentasulfure de diphosphore a un point d’ébullition d’environ 514 degrés Celsius (957 degrés Fahrenheit). À cette température, le composé subit une transition de phase d’un liquide à un gaz.
Pentasulfure de phosphore Point de fusion
Le point de fusion du pentasulfure de diphosphore est d’environ 280 degrés Celsius (536 degrés Fahrenheit). C’est la température à laquelle le composé passe de l’état solide à l’état liquide.
Densité du pentasulfure de phosphore g/mL
La densité du pentasulfure de diphosphore est d’environ 2,02 g/mL. Cela indique que le composé est relativement dense, avec une masse par unité de volume élevée.
Pentasulfure De Phosphore Poids moléculaire
Le poids moléculaire du pentasulfure de diphosphore, qui est la somme des poids atomiques de ses éléments constitutifs, est d’environ 222,27 g/mol.
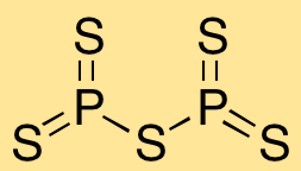
Structure du pentasulfure de phosphore
Le pentasulfure de diphosphore a une structure moléculaire dans laquelle deux atomes de phosphore sont liés à cinq atomes de soufre. La disposition des atomes forme une forme bipyramidale trigonale, avec les atomes de phosphore au centre et les atomes de soufre qui les entourent.
Solubilité du pentasulfure de phosphore
Le pentasulfure de diphosphore est peu soluble dans l’eau, ce qui signifie qu’il ne se dissout que dans une mesure limitée. Cependant, il est plus soluble dans les solvants organiques tels que le benzène et le sulfure de carbone.
| Apparence | Solide jaune |
| Gravité spécifique | 2.02 |
| Couleur | Jaune |
| Odeur | Odeur âcre |
| Masse molaire | 222,27 g/mole |
| Densité | 2,02 g/ml |
| Point de fusion | 280°C (536°F) |
| Point d’ébullition | 514°C (957°F) |
| Point d’éclair | Pas disponible |
| Solubilité dans l’eau | Peu soluble |
| Solubilité | Soluble dans les solvants organiques tels que le benzène et le sulfure de carbone |
| La pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Pas disponible |
Sécurité et dangers du pentasulfure de phosphore
Le pentasulfure de diphosphore présente plusieurs risques pour la sécurité et des précautions doivent être prises lors de sa manipulation. Il peut provoquer une grave irritation et des brûlures de la peau, des yeux et du système respiratoire par contact ou par inhalation. Le contact direct avec le composé doit être évité et des gants de protection, des lunettes et un équipement respiratoire doivent être utilisés. Il est également inflammable et peut s’enflammer lorsqu’il est exposé à la chaleur ou aux flammes, produisant des oxydes de soufre toxiques. Un stockage approprié loin des sources d’inflammation est nécessaire. De plus, le pentasulfure de diphosphore ne doit pas être mélangé avec de l’eau ou des substances réactives car il peut générer des gaz inflammables ou toxiques. Une ventilation adéquate et le respect des protocoles de sécurité sont cruciaux lorsque l’on travaille avec ce composé.
| Symboles de danger | Inflammable, Irritant |
| Description de la sécurité | Provoque de graves brûlures de la peau et des lésions oculaires. Nocif en cas d’inhalation. Solide inflammable. |
| Numéros d’identification de l’ONU | ONU 1340 |
| Code SH | 2812120000 |
| Classe de danger | 4.2 (solide inflammable), 8 (corrosif) |
| Groupe d’emballage | II |
| Toxicité | Toxique |
Méthodes de synthèse du pentasulfure de phosphore
Différentes méthodes permettent de synthétiser le pentasulfure de diphosphore.
Une méthode courante de synthèse du pentasulfure de diphosphore consiste à chauffer ensemble le phosphore élémentaire et le soufre dans un environnement contrôlé, généralement dans un récipient scellé. La température élevée facilite la réaction, conduisant à la formation de pentasulfure de diphosphore.
Une autre méthode consiste à mélanger du trisulfure de phosphore (P4S3) avec un excès de soufre et à chauffer le mélange pour favoriser la réaction. L’excès de soufre se combine avec le trisulfure de phosphore, entraînant la production de pentasulfure de diphosphore.
La réaction du pentachlorure de phosphore (PCl5) avec le sulfure d’hydrogène (H2S) en présence d’un solvant approprié, comme le disulfure de carbone, permet la préparation de pentasulfure de diphosphore. La réaction génère du pentasulfure de diphosphore et libère du chlorure d’hydrogène (HCl) gazeux comme sous-produit.
Veuillez faire preuve de prudence lorsque vous utilisez ces méthodes de synthèse en raison de la nature dangereuse des réactifs et des produits impliqués. Assurer des mesures de sécurité appropriées, telles que l’utilisation d’un équipement de protection approprié et le travail dans des zones bien ventilées, pendant le processus de synthèse.
Utilisations du pentasulfure de phosphore
Le pentasulfure de diphosphore trouve des applications dans diverses industries et processus en raison de ses propriétés uniques. Voici quelques-unes de ses utilisations :
- Production d’insecticides : les fabricants utilisent le pentasulfure de diphosphore comme ingrédient clé dans la fabrication d’insecticides, en particulier ceux destinés à lutter contre les ravageurs comme les moustiques et les tiques.
- Additif pour lubrifiant : les entreprises ajoutent du pentasulfure de diphosphore aux lubrifiants comme additif pour améliorer leurs propriétés extrême pression et anti-usure. Cet additif améliore les performances lubrifiantes et protège les machines dans des conditions de contraintes élevées.
- Synthèse chimique : Le pentasulfure de diphosphore agit comme réactif dans plusieurs réactions chimiques, comme la synthèse du chlorure de thionyle (SOCl2), largement utilisé en synthèse organique.
- Industrie pharmaceutique : L’industrie pharmaceutique utilise le pentasulfure de diphosphore dans les processus de recherche et développement pour synthétiser des composés et des intermédiaires spécifiques.
- Extraction de métaux : les procédés métallurgiques utilisent du pentasulfure de diphosphore pour extraire certains métaux, notamment le cuivre et le zinc, de leurs minerais. Il aide à éliminer les impuretés et facilite la purification des métaux.
- Production de colorants et de pigments : le pentasulfure de diphosphore joue un rôle dans la synthèse de divers colorants et pigments, servant d’élément de base clé pour leur structure chimique.
- Agents de guerre chimique : Historiquement, le pentasulfure de diphosphore a été utilisé dans la production d’agents de guerre chimique. Cependant, les traités internationaux réglementent et contrôlent strictement son utilisation à ces fins.
Il est important de noter qu’en raison de la nature dangereuse du pentasulfure de diphosphore, des mesures et protocoles de sécurité appropriés doivent être suivis lors de sa manipulation, de son stockage et de son élimination.
Des questions:
Q : Qu’est-ce que le dimère de pentasulfure de phosphore ?
R : Le dimère de pentasulfure de diphosphore fait référence à la structure moléculaire de deux molécules de pentasulfure de phosphore liées chimiquement ensemble.
Q : Quelle est l’entropie du pentasulfure de phosphore ?
R : L’entropie du pentasulfure de diphosphore fait référence à la mesure de son désordre moléculaire ou de son caractère aléatoire à une température donnée.
Q : Quelle est l’enthalpie du pentasulfure de phosphore ?
R : L’enthalpie du pentasulfure de diphosphore fait référence au contenu thermique ou au changement d’énergie associé à ses réactions ou transformations chimiques.
Q : Qu’est-ce que P2S5 ?
R : P2S5 est la formule moléculaire du pentasulfure de diphosphore, un composé composé de deux atomes de phosphore liés à cinq atomes de soufre.
Q : Combien de grammes de soufre sont contenus dans 45,0 g de P2S5 ?
R : 45,0 g de P2S5 contiennent environ 28,13 g de soufre.
Q : Combien de molécules de P2S5 faut-il pour obtenir 222 grammes ?
R : Environ 1,54 x 10^23 molécules de P2S5 sont nécessaires pour équivaloir à 222 grammes.
Q : Quel est le nom de P2S5 ?
R : Le nom du P2S5 est pentasulfure de phosphore.
Q : Le P2S5 est-il un électrolyte faible ?
R : Non, le P2S5 n’est pas un électrolyte faible ; c’est un non-électrolyte.
Q : Comment savoir si la taille des particules P2S5 est incorrecte ?
R : Une taille de particule incorrecte du P2S5 peut être déterminée en observant des écarts par rapport aux propriétés physiques et au comportement attendus du composé.
Q : Qu’est-ce que P2S5 ochem2 ?
R : « ochem2 » n’est pas un terme ou une désignation reconnu pour P2S5 dans le domaine de la chimie organique.
Q : Comment s’appelle le composé P2S5 ?
R : Le composé P2S5 est appelé pentasulfure de diphosphore.
Q : Qu’est-ce que le P2S5 en chimie ?
R : En chimie, P2S5 représente la formule moléculaire du pentasulfure de diphosphore, un composé utilisé dans diverses applications et réactions chimiques.
