Le pentachlorure de phosphore est un composé chimique de formule PCl5. Il est utilisé comme réactif dans diverses réactions chimiques. Il réagit vigoureusement avec l’eau, libérant du chlorure d’hydrogène gazeux.
| Nom UICPA | Pentachlorure de phosphore |
| Formule moléculaire | PCl5 |
| Numero CAS | 10026-13-8 |
| Synonymes | Pentachlorophosphorane, chlorure de phosphore (V), chlorure de phosphore, chlorure de phosphore (V) |
| InChI | InChI=1S/Cl5P/c1-6(2,3,4)5 |
Propriétés du pentachlorure de phosphore
Formule de pentachlorure de phosphore
La formule du pentachlorure de phosphore est PCl5. Il se compose d’un atome de phosphore lié à cinq atomes de chlore. La formule représente le rapport des atomes dans le composé.
Pentachlorure De Phosphore Masse molaire
La masse molaire du chlorure de phosphore (V) est calculée en additionnant les masses atomiques de tous ses éléments constitutifs. Le phosphore a une masse molaire d’environ 30,97 grammes par mole et chaque atome de chlore a une masse molaire d’environ 35,45 grammes par mole. Leur addition donne une masse molaire d’environ 208,24 grammes par mole pour le chlorure de phosphore (V).
Point d’ébullition du pentachlorure de phosphore
Le chlorure de phosphore (V) a un point d’ébullition d’environ 167,8 degrés Celsius. À cette température, le composé subit un changement de phase d’un liquide à un gaz. Le point d’ébullition est influencé par les forces intermoléculaires présentes dans le composé.
Pentachlorure de phosphore Point de fusion
Le point de fusion du chlorure de phosphore (V) est d’environ -93,6 degrés Celsius. C’est la température à laquelle le composé passe de l’état solide à l’état liquide. Le point de fusion est une propriété importante pour déterminer le comportement physique du composé.
Densité du pentachlorure de phosphore g/mL
La densité du chlorure de phosphore (V) est d’environ 2,1 grammes par millilitre. La densité représente la masse d’une substance par unité de volume. La densité du chlorure de phosphore (V) aide à comprendre sa disposition et la compacité de ses particules.
Pentachlorure De Phosphore Poids moléculaire
Le poids moléculaire du chlorure de phosphore (V) est d’environ 208,24 grammes par mole. C’est la somme des poids atomiques de tous les atomes présents dans le composé. Le poids moléculaire est utile dans divers calculs, tels que la détermination de la quantité de substance dans une masse ou un volume donné.
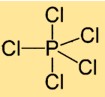
Structure du pentachlorure de phosphore
Le chlorure de phosphore (V) a une structure moléculaire dans laquelle un atome de phosphore est entouré de cinq atomes de chlore. Les atomes de chlore sont disposés symétriquement autour de l’atome central de phosphore, formant une géométrie bipyramidale trigonale.
Solubilité du pentachlorure de phosphore
Le chlorure de phosphore (V) est peu soluble dans l’eau. Il réagit vigoureusement avec l’eau, libérant du chlorure d’hydrogène gazeux. Cependant, il se dissout facilement dans les solvants polaires tels que le benzène et le tétrachlorure de carbone. La solubilité du chlorure de phosphore (V) est influencée par la polarité et les propriétés chimiques du solvant.
| Apparence | Cristaux incolores |
| Gravité spécifique | 2,1 g/ml |
| Couleur | Incolore |
| Odeur | Âcre |
| Masse molaire | 208,24 g/mole |
| Densité | 2,1 g/ml |
| Point de fusion | -93,6 °C |
| Point d’ébullition | 167,8 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit vigoureusement |
| Solubilité | Soluble dans les solvants polaires tels que le benzène et le tétrachlorure de carbone |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | N’est pas applicable |
Sécurité et dangers du pentachlorure de phosphore
Le chlorure de phosphore (V) présente plusieurs risques pour la sécurité. Il est corrosif et peut provoquer de graves brûlures à la peau, aux yeux et au système respiratoire au contact. L’inhalation de ses fumées ou poussières peut entraîner une irritation et des dommages respiratoires. Le composé réagit violemment avec l’eau, libérant du chlorure d’hydrogène gazeux toxique. Il est également très réactif avec les matières organiques, provoquant potentiellement des incendies ou des explosions. Des précautions appropriées doivent être prises lors de la manipulation du chlorure de phosphore (V), y compris l’utilisation d’équipements de protection comme des gants, des lunettes et un respirateur. Il doit être stocké et manipulé dans un endroit bien ventilé, à l’écart des substances incompatibles, afin de prévenir les accidents et de minimiser les risques.
| Symboles de danger | Corrosif |
| Description de la sécurité | Manipulez avec prudence. Utiliser un équipement de protection approprié. |
| Numéros d’identification de l’ONU | UN1806 |
| Code SH | 2812.20.00 |
| Classe de danger | 8 (Substances corrosives) |
| Groupe d’emballage | II (Danger modéré) |
| Toxicité | Toxique par ingestion ou inhalation. Peut provoquer une grave irritation. |
Méthodes de synthèse du pentachlorure de phosphore
Diverses méthodes permettent la synthèse du chlorure de phosphore (V). Une méthode courante implique la réaction entre le trichlorure de phosphore (PCl3) et le chlore gazeux (Cl2) . Dans ce processus, le récipient de réaction combine à la fois les composés et la chaleur ou un catalyseur comme le fer initie la réaction. Le chlore gazeux agit comme un agent oxydant, convertissant le PCl3 en PCl5. La réaction se déroule comme suit :
PCl3 + Cl2 → PCl5
Une autre méthode de synthèse du chlorure de phosphore (V) implique la réaction entre le phosphore et le chlore gazeux. Cette méthode est plus directe et implique la réaction suivante :
P4 + 10Cl2 → 4PCl5
Dans cette réaction, le phosphore et le chlore gazeux réagissent dans des conditions appropriées, entraînant la formation de chlorure de phosphore (V).
Il est important de noter que les deux méthodes de synthèse nécessitent une manipulation soigneuse et des précautions de sécurité appropriées. Les réactions impliquent des substances hautement réactives et corrosives, un équipement de protection et une ventilation adéquate sont donc nécessaires. De plus, il est essentiel d’effectuer ces réactions dans un environnement contrôlé pour prévenir les accidents et assurer la sécurité du personnel impliqué.
Utilisations du pentachlorure de phosphore
Le chlorure de phosphore (V) trouve diverses applications en raison de ses propriétés et de sa réactivité uniques. Voici quelques-unes de ses utilisations :
- Synthèse chimique : la synthèse organique utilise largement le chlorure de phosphore (V) comme réactif pour convertir les acides carboxyliques en chlorures d’acide et les alcools en chlorures d’alkyle.
- Produits pharmaceutiques : La synthèse de composés pharmaceutiques, notamment d’antibiotiques et de colorants, repose fortement sur le chlorure de phosphore (V) comme intermédiaire clé.
- Catalyseur : Le chlorure de phosphore (V) catalyse plusieurs réactions chimiques, telles que l’acylation de Friedel-Crafts et le réarrangement de Beckmann.
- Industrie des polymères : La production de divers polymères, notamment le chlorure de polyvinyle (PVC) et les polycarbonates, utilise le chlorure de phosphore (V) comme agent de chloration.
- Applications en laboratoire : Dans les applications en laboratoire, le chlorure de phosphore (V) agit comme agent desséchant pour éliminer les traces d’eau des appareils de laboratoire et comme agent de chloration et de déshydratation dans diverses réactions.
- Herbicides et pesticides : La production d’herbicides et de pesticides pour contrôler la croissance des mauvaises herbes et éliminer les ravageurs implique l’utilisation de chlorure de phosphore (V).
- Agents de guerre chimique : Historiquement, le chlorure de phosphore(V) a activement contribué à la production d’agents de guerre chimique, mais son utilisation à de telles fins est désormais soumise à des réglementations et restrictions strictes.
- Traitement de surface métallique : les processus de traitement de surface métallique utilisent du chlorure de phosphore (V) pour améliorer les propriétés d’adhérence et favoriser la résistance à la corrosion.
- Ignifugeants : La production d’additifs ignifuges pour les textiles, les plastiques et d’autres matériaux incorpore du chlorure de phosphore (V).
- Fabrication de produits pharmaceutiques : Le chlorure de phosphore (V) trouve des applications dans la production de divers produits pharmaceutiques, notamment la synthèse de vitamines et de dérivés hormonaux.
Il est important de manipuler le chlorure de phosphore (V) avec précaution et de suivre les protocoles de sécurité appropriés en raison de sa nature corrosive et de ses risques potentiels pour la santé.
Des questions:
Q : Quelle est la formule correcte pour le pentachlorure de phosphore ?
R : La formule correcte pour le chlorure de phosphore (V) est PCl5.
Q : Quelle est la formule moléculaire du pentachlorure de phosphore ?
R : La formule moléculaire du chlorure de phosphore (V) est PCl5.
Q : Quelle masse de pentachlorure de phosphore serait produite par la réaction complète de 15,2 g de P4 ?
R : La masse de chlorure de phosphore (V) produite serait d’environ 208,24 g.
Q : Quelle est la forme du pentachlorure de phosphore ?
R : La forme du chlorure de phosphore (V) est bipyramidale trigonale.
Q : Quelle est la masse d’une molécule de pentachlorure de phosphore ?
R : La masse d’une molécule de chlorure de phosphore (V) est d’environ 208,24 grammes par mole.
Q : Propriétés du pentachlorure de phosphore ?
R : Le chlorure de phosphore (V) est corrosif, réagit violemment avec l’eau et est utilisé comme réactif dans la synthèse chimique.
Q : Angles de liaison du chlorure de phosphore (V) ?
R : Les angles de liaison dans le pentachlorure de phosphore sont d’environ 120 degrés (entre les atomes de chlore équatoriaux) et 90 degrés (entre les atomes de chlore axiaux).
Q : Comment fabriquer du pentachlorure de phosphore ?
R : Le chlorure de phosphore (V) peut être fabriqué en faisant réagir du trichlorure de phosphore (PCl3) avec du chlore gazeux (Cl2) ou par réaction directe entre le phosphore et le chlore gazeux.
Q : Quelle est la géométrie électronique du phosphore dans le pentachlorure de phosphore ?
R : La géométrie électronique du phosphore dans le chlorure de phosphore (V) est bipyramidale trigonale.
