L’oxyde d’or (Au2O3) est un composé formé d’or et d’oxygène. Il présente des propriétés différentes de celles de l’or métallique, ce qui le rend intéressant dans diverses applications scientifiques et industrielles.
| Nom UICPA | Oxyde d’or (III) |
| Formule moléculaire | Au2O3 |
| Numero CAS | 1303-58-8 |
| Synonymes | Oxyde aurique, sesquioxyde d’or, trioxyde d’or, trioxyde de digold |
| InChI | InChI=1S/2Au.3O |
Propriétés de l’oxyde d’or (III)
Formule d’oxyde d’or
La formule du trioxyde d’or est Au2O3. Il est composé de deux atomes d’or et de trois atomes d’oxygène. Cette formule chimique indique le rapport des éléments dans le composé.
Oxyde D’or Masse molaire
La masse molaire du trioxyde d’or (Au2O3) peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. La masse molaire de l’or (Au) est de 196,97 g/mol et celle de l’oxygène (O) est de 16,00 g/mol. Ainsi, la masse molaire de Au2O3 est d’environ 441,97 g/mol.
Point d’ébullition de l’oxyde d’or
Le trioxyde d’or n’a pas de point d’ébullition distinct puisqu’il subit une décomposition avant d’atteindre un état d’ébullition. Lorsqu’il est chauffé, il se décompose en ses éléments constitutifs.
Point de fusion de l’oxyde d’or
Le trioxyde d’or a un point de fusion d’environ 1 600 °C (2 912 °F). À cette température, le trioxyde d’or solide passe à l’état liquide, facilitant diverses applications dans les processus à haute température.
Densité d’oxyde d’or g/mL
La densité du trioxyde d’or est d’environ 11,34 g/mL. Cette valeur indique sa masse par unité de volume et signifie sa densité élevée par rapport à de nombreux autres matériaux.
Poids moléculaire de l’oxyde d’or
Le poids moléculaire du trioxyde d’or (Au2O3) est d’environ 441,97 g/mol. Cette valeur représente la somme des poids atomiques de tous les atomes d’une molécule du composé.
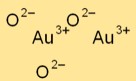
Structure de l’oxyde d’or
Le trioxyde d’or (Au2O3) possède une structure cristalline complexe. Il présente un arrangement de réseau rhomboédrique, avec des atomes d’or et d’oxygène formant des motifs spécifiques au sein du réseau cristallin.
Solubilité de l’oxyde d’or
Le trioxyde d’or (Au2O3) est généralement insoluble dans l’eau et la plupart des solvants organiques. Il affiche une faible solubilité, ce qui signifie que seules des quantités infimes se dissolvent, ce qui conduit à sa réactivité souvent faible dans les solutions aqueuses.
| Apparence | Solide |
| Gravité spécifique | N / A |
| Couleur | Noir ou noir brunâtre |
| Odeur | Inodore |
| Masse molaire | 441,97 g/mole |
| Densité | 11,34 g/ml |
| Point de fusion | 1600°C (2912°F) |
| Point d’ébullition | Se décompose |
| Point d’éclair | N / A |
| Solubilité dans l’eau | Insoluble |
| Solubilité | faible réactivité dans les solutions aqueuses |
| Pression de vapeur | N / A |
| Densité de vapeur | N / A |
| pKa | N / A |
| pH | N / A |
Sécurité et dangers de l’oxyde d’or
Le trioxyde d’or soulève plusieurs considérations de sécurité et de danger. Il peut être irritant s’il entre en contact avec la peau, les yeux ou le système respiratoire. Un équipement de protection approprié, tel que des gants et des lunettes, doit être utilisé pendant la manipulation. De plus, le trioxyde d’or ne convient pas à l’ingestion ou à l’inhalation, car il peut avoir des effets néfastes sur la santé. Lorsque vous travaillez avec ce composé, assurez-vous d’une bonne ventilation pour minimiser le risque d’exposition à ses poussières ou à ses fumées. De plus, en cas d’ingestion ou d’exposition accidentelle, consulter immédiatement un médecin. Des pratiques appropriées de stockage et de manipulation sont essentielles pour garantir l’utilisation sûre du trioxyde d’or dans les laboratoires et les milieux industriels.
| Symboles de danger | Irritant |
| Description de la sécurité | Irritant, Éviter l’inhalation, Corrosion cutanée, Lésions oculaires graves |
| Numéros d’identification de l’ONU | N / A |
| Code SH | N / A |
| Classe de danger | N / A |
| Groupe d’emballage | N / A |
| Toxicité | Faible |
Veuillez noter que certaines propriétés, telles que les identifiants ONU, le code HS, la classe de danger et le groupe d’emballage, peuvent ne pas être applicables ou ne pas être bien définies pour l’oxyde d’or.
Méthodes de synthèse de l’oxyde d’or
Diverses méthodes permettent la synthèse du trioxyde d’or.
Une approche courante implique la réaction de l’or métallique avec l’ozone gazeux à des températures élevées. Au cours de ce processus, l’or réagit avec l’ozone pour former du trioxyde d’or. Une autre méthode comprend la décomposition thermique des sels d’or, tels que le nitrate d’or ou l’hydroxyde d’or. Lorsqu’ils sont chauffés, ces composés se décomposent, produisant du trioxyde d’or comme l’un des produits.
On peut préparer du trioxyde d’or par précipitation. Cela implique de mélanger une solution de sel d’or avec un agent précipitant approprié, tel qu’un hydroxyde de métal alcalin, NaOH . Par la suite, un traitement ultérieur du précipité résultant donne du trioxyde d’or pur.
De plus, l’électrolyse d’un électrolyte contenant de l’or peut conduire à la formation de trioxyde d’or à la surface de l’anode. Cette méthode est particulièrement utile pour produire des films minces de trioxyde d’or.
Les chercheurs peuvent choisir une méthode de synthèse spécifique en fonction de facteurs tels que la pureté souhaitée, la taille des particules et l’application du trioxyde d’or. Un contrôle minutieux des conditions de réaction est essentiel pour obtenir le produit souhaité doté de propriétés optimales pour des utilisations spécifiques.
Utilisations de l’oxyde d’or
Le trioxyde d’or trouve diverses applications en raison de ses propriétés uniques. Voici ses utilisations :
- Catalyse : le trioxyde d’or agit comme un catalyseur dans certaines réactions chimiques, notamment l’oxydation du monoxyde de carbone et d’autres hydrocarbures. Il est précieux dans les processus industriels pour son efficacité catalytique.
- Coloration du verre : Le trioxyde d’or confère une couleur rouge caractéristique au verre, ce qui le rend utile à des fins décoratives et pour la création d’art en vitrail.
- Recherche : Les scientifiques utilisent le trioxyde d’or dans diverses études de recherche, notamment la recherche sur la catalyse, la science des matériaux et les nanotechnologies.
- Photocatalyse : Le trioxyde d’or présente des propriétés photocatalytiques, permettant la dégradation des polluants organiques dans l’eau et l’air lorsqu’ils sont exposés à la lumière.
- Piles à combustible : Le trioxyde d’or sert de catalyseur dans les piles à combustible, renforçant les réactions électrochimiques et améliorant leur efficacité.
- Synthèse chimique : Le trioxyde d’or facilite la synthèse d’autres composés d’or, comme les nanoparticules d’or, qui trouvent des applications dans divers domaines.
- Médecine : Les chercheurs ont exploré les applications médicales potentielles du trioxyde d’or, notamment le traitement du cancer et ses propriétés antimicrobiennes.
- Technologie des capteurs : les fabricants utilisent des capteurs à base de trioxyde d’or dans les dispositifs de détection de gaz, la surveillance de l’environnement et la détection de substances dangereuses.
- Électronique : les fabricants utilisent des films minces de trioxyde d’or dans l’électronique, par exemple dans la fabrication de semi-conducteurs et de résistances, en raison de son point de fusion élevé et de sa stabilité.
- Nanotechnologie : En nanotechnologie, les chercheurs utilisent des nanoparticules de trioxyde d’or comme matériaux prometteurs pour les systèmes d’administration de médicaments et les diagnostics médicaux, grâce à leur biocompatibilité.
Ces applications démontrent la polyvalence et l’importance du trioxyde d’or dans diverses industries, contribuant ainsi aux progrès de la technologie, de la science et des soins de santé.
Des questions:
Q : Quel est le nombre d’oxydation de l’Au dans Au2O3 ?
R : Le nombre d’oxydation de Au dans Au2O3 est de +3.
Q : Quel volume d’O2 à STP est produit à partir de la réaction de 212 grammes d’Au2O3 ?
R : Environ 160,7 litres d’O2 à STP seront produits à partir de la réaction de 212 grammes d’Au2O3.
Q : À quoi sert Au2O3 ?
R : Au2O3 a des applications en tant que catalyseur, dans les domaines de l’électronique, de la nanotechnologie, de la coloration du verre et des études de recherche.
Q : Combien de grammes d’or y aura-t-il dans une tonne métrique (1 000 kg) d’Au2O3 ?
R : Il y aura environ 432,09 grammes d’or dans une tonne métrique (1 000 kg) d’Au2O3.
Q : Combien de grammes d’or y aura-t-il dans une tonne d’Au2O3 ?
R : Il y aura environ 432 090 grammes d’or dans une tonne d’Au2O3.
Q : L’oxyde d’or (III) est-il ionique ou moléculaire ?
R : L’oxyde d’or (III) (Au2O3) est un composé ionique.
Q : À quoi sert l’oxyde d’or (III) ?
R : L’oxyde d’or (III) est utilisé dans les applications de catalyse, d’électronique, de nanotechnologie, de coloration du verre et de piles à combustible.
Q : Quelle est la formule chimique de l’oxyde d’or (III) ?
R : La formule chimique de l’oxyde d’or (III) est Au2O3.
