L’oxyde de phosphore (P2O5) est un composé chimique. Il est formé de la combinaison de deux atomes de phosphore et de cinq atomes d’oxygène.
| Nom de l’UICPA | Pentoxyde de phosphore |
| Formule moléculaire | P2O5 |
| Numero CAS | 1314-56-3 |
| Synonymes | Anhydride phosphorique, oxyde de phosphore (V), pentoxyde de diphosphore |
| InChI | InChI=1S/2O.P2/c2*1-3-2 |
Propriétés de l’oxyde de phosphore
Formule d’oxyde de phosphore
La formule du pentoxyde de diphosphore est P2O5. Il est constitué de deux atomes de phosphore et de cinq atomes d’oxygène. Cette formule chimique représente le rapport des éléments dans le composé.
Oxyde De Phosphore Masse molaire
La masse molaire du pentoxyde de diphosphore (P2O5) est calculée en additionnant les masses atomiques de ses éléments constitutifs. Le phosphore a une masse atomique d’environ 31,0 grammes par mole, tandis que l’oxygène a une masse atomique d’environ 16,0 grammes par mole. La masse molaire du P2O5 est donc d’environ 141,9 grammes par mole.
Point d’ébullition de l’oxyde de phosphore
Le pentoxyde de diphosphore n’a pas de point d’ébullition spécifique. Au lieu de cela, il subit une réaction chimique lorsqu’il est chauffé, se transformant en acide phosphorique (H3PO4) et libérant de la chaleur au cours du processus. Par conséquent, il n’a pas de point d’ébullition bien défini comme beaucoup d’autres composés.
Point de fusion de l’oxyde de phosphore
Le pentoxyde de diphosphore (P2O5) a un point de fusion d’environ 340 degrés Celsius (644 degrés Fahrenheit). A cette température, le composé solide se transforme à l’état liquide. Il est important de noter que le pentoxyde de diphosphore est hautement hygroscopique, ce qui signifie qu’il absorbe facilement l’humidité de l’air.
Densité d’oxyde de phosphore g/mL
La densité du pentoxyde de diphosphore est d’environ 2,39 grammes par millilitre (g/mL). La densité est une mesure de masse par unité de volume, et cette valeur indique la lourdeur ou la compacité de la substance. La densité du pentoxyde de diphosphore contribue à ses propriétés physiques et à son comportement dans diverses applications.
Poids moléculaire de l’oxyde de phosphore
Le poids moléculaire du pentoxyde de diphosphore (P2O5) est d’environ 141,9 grammes par mole. Cette valeur représente la somme des masses atomiques de phosphore et d’oxygène dans le composé. Le poids moléculaire est souvent utilisé dans les calculs impliquant des réactions chimiques et la stœchiométrie des composés.
Structure de l’oxyde de phosphore
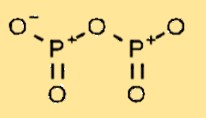
Le pentoxyde de diphosphore a une structure moléculaire composée de deux atomes de phosphore liés à cinq atomes d’oxygène. L’arrangement des atomes forme une structure cyclique, chaque atome de phosphore étant lié à deux atomes d’oxygène et partageant une double liaison avec l’atome de phosphore voisin.
Solubilité de l’oxyde de phosphore
Le pentoxyde de diphosphore n’est pas soluble dans l’eau. Il réagit vigoureusement avec l’eau pour former de l’acide phosphorique, libérant ainsi de la chaleur. Cependant, il est soluble dans certains solvants organiques tels que le sulfure de carbone et le chloroforme. Les caractéristiques de solubilité du pentoxyde de diphosphore jouent un rôle dans sa réactivité chimique et ses applications.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2,39 g/ml |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 141,9 g/mole |
| Densité | 2,39 g/ml |
| Point de fusion | 340°C (644°F) |
| Point d’ébullition | Réagit pour former de l’acide phosphorique |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit avec l’eau pour former de l’acide phosphorique |
| Solubilité | Soluble dans les solvants organiques tels que le disulfure de carbone, le chloroforme |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers de l’oxyde de phosphore
Le pentoxyde de diphosphore (P2O5) présente certains risques pour la sécurité et des précautions doivent être prises lors de sa manipulation. Il réagit violemment avec l’eau, dégageant de la chaleur et formant de l’acide phosphorique, ce qui peut provoquer des brûlures et des irritations de la peau, des yeux et du système respiratoire. Il est important d’éviter tout contact avec la substance et d’utiliser un équipement de protection approprié, tel que des gants, des lunettes et un respirateur, lorsque vous travaillez avec du pentoxyde de diphosphore. De plus, il est crucial de stocker le composé dans un récipient hermétiquement fermé, à l’abri de l’humidité et des matières incompatibles. Une ventilation adéquate doit être assurée pour éviter l’accumulation de vapeurs.
| Symboles de danger | Corrosif, nocif |
| Description de la sécurité | – Provoque des brûlures de la peau et des lésions oculaires graves – Peut être nocif en cas d’ingestion ou d’inhalation – Réagit violemment avec l’eau – Conserver à l’écart de l’humidité et des matières incompatibles |
| Numéros d’identification de l’ONU | ONU 1807 |
| Code SH | 2819.10.90 |
| Classe de danger | Classe 8 (substances corrosives) |
| Groupe d’emballage | PG II (Danger moyen) |
| Toxicité | Toxique pour la vie aquatique, peut entraîner des effets néfastes à long terme pour l’environnement aquatique |
Méthodes de synthèse de l’oxyde de phosphore
Diverses méthodes permettent de synthétiser du pentoxyde de diphosphore (P2O5).
Une méthode courante implique la combustion du phosphore en présence d’un excès d’oxygène. Cette réaction produit du pentoxyde de phosphore sous forme de résidu solide blanc. L’équation de ce processus est P4 + 5O2 → 2P2O5.
Une autre méthode implique l’oxydation contrôlée de composés du phosphore, tels que le trichlorure de phosphore (PCl3) ou le tribromure de phosphore (PBr3) , à l’aide d’oxygène ou d’air. La réaction a généralement lieu à des températures élevées et le produit résultant est du pentoxyde de phosphore.
Afin d’obtenir du pentoxyde de diphosphore, on peut déshydrater l’acide phosphorique (H3PO4) en le chauffant à haute température. Ce processus élimine les molécules d’eau et entraîne la formation de pentoxyde de phosphore.
Une autre méthode de préparation du pentoxyde de diphosphore implique la décomposition thermique de certains sels de phosphate. Par exemple, le chauffage du dihydrogénophosphate d’ammonium (NH4H2PO4) ou du phosphate d’ammonium ((NH4)3PO4) conduit à la formation de pentoxyde de phosphore.
Lors de la synthèse du pentoxyde de diphosphore, il est crucial de faire preuve de prudence en raison de sa réactivité et de la génération de chaleur lors de réactions spécifiques. Il faut respecter les mesures de sécurité appropriées, comme travailler dans un endroit bien ventilé et porter un équipement de protection approprié.
Ces méthodes de synthèse offrent des voies d’acquisition de pentoxyde de diphosphore, qui trouve des applications dans divers domaines, notamment la production d’acide phosphorique, d’engrais et d’intermédiaires chimiques.
Utilisations de l’oxyde de phosphore
Le pentoxyde de diphosphore (P2O5) trouve diverses applications dans plusieurs industries en raison de ses propriétés uniques. Voici quelques utilisations courantes du pentoxyde de diphosphore :
- Production d’acide phosphorique : La fabrication d’acide phosphorique utilise largement le pentoxyde de diphosphore comme précurseur clé. L’acide phosphorique trouve de nombreuses applications dans les engrais, les additifs alimentaires et les agents de nettoyage.
- Fabrication d’engrais : le pentoxyde de diphosphore joue un rôle essentiel dans la production de divers engrais à base de phosphate, notamment les engrais au superphosphate et au phosphate d’ammonium. Ces engrais fournissent aux plantes les nutriments essentiels pour favoriser une croissance saine.
- Intermédiaires chimiques : La synthèse de divers composés organiques, tels que les produits pharmaceutiques, les pesticides et les retardateurs de flamme, repose sur le pentoxyde de diphosphore comme intermédiaire chimique.
- Agent déshydratant : Le pentoxyde de diphosphore présente une forte affinité pour l’eau et agit comme un agent déshydratant. Il est utilisé dans plusieurs réactions chimiques pour éliminer l’eau et faire avancer les réactions souhaitées.
- Catalyseur : Le pentoxyde de diphosphore agit comme un catalyseur dans des réactions chimiques spécifiques. Il facilite ces réactions en réduisant l’énergie d’activation et en augmentant ainsi les vitesses de réaction.
- Déshydratant : La nature hygroscopique du pentoxyde de diphosphore le rend approprié pour une utilisation comme déshydratant dans les applications sensibles à l’humidité. Il absorbe et élimine efficacement l’humidité de l’environnement.
- Fabrication du verre : les formulations de verre incorporent du pentoxyde de diphosphore pour modifier leurs propriétés, notamment la dilatation thermique et l’indice de réfraction. Les verres spécialisés, tels que les verres optiques et les verres borosilicatés, l’utilisent activement.
- Traitement des surfaces métalliques : Les traitements de surfaces métalliques, tels que la phosphatation, utilisent du pentoxyde de diphosphore pour améliorer la résistance à la corrosion et améliorer l’adhérence de la peinture sur les surfaces métalliques.
Ces diverses applications mettent en évidence l’importance du pentoxyde de diphosphore dans des industries allant de l’agriculture aux produits pharmaceutiques, ce qui en fait un composé précieux et largement utile.
Des questions:
Q : Quel est le nombre d’oxydation du phosphore dans l’ion PO ?
R : Le nombre d’oxydation du phosphore dans l’ion PO est de +5.
Q : Quel est l’état d’oxydation d’un atome de phosphore individuel dans PO43− ?
R : L’état d’oxydation d’un atome de phosphore individuel dans PO43− est +5.
Q : Quel est l’indice d’oxydation du phosphore ?
R : L’indice d’oxydation du phosphore peut varier, mais il apparaît généralement comme +3 ou +5.
Q : Quel est le nom du composé P2O5 ?
R : Le nom du composé P2O5 est pentoxyde de phosphore (V).
Q : Qu’est-ce que le P2O5 ?
R : P2O5 est un composé chimique appelé pentoxyde de phosphore (V).
Q : Quel est le nom correct pour P2O5 ?
R : Le nom correct pour P2O5 est pentoxyde de phosphore (V).
Q : Quel est le nom du P2O5 ?
R : Le nom du P2O5 est pentoxyde de phosphore (V).
Q : Le P2O5 est-il amphotère ?
R : Non, le P2O5 n’est pas amphotère. C’est un oxyde acide.
Q : Qu’est-ce que l’engrais P2O5 ?
R : L’engrais P2O5 fait référence aux engrais qui contiennent du pentoxyde de phosphore (V) (P2O5) comme source de phosphore, ce qui est important pour la croissance des plantes.
Q : Le P2O5 est-il acide ou basique ?
R : P2O5 est un composé acide.
Q : Le P2O5 est-il un composé ionique ?
R : Non, P2O5 est un composé covalent.
Q : Comment calculer le P2O5 dans les engrais ?
R : Pour calculer la quantité de P2O5 dans un engrais, multipliez le pourcentage de P2O5 par le poids de l’engrais.
Q : Propriétés du P2O5, soluble ?
R : Le P2O5 est peu soluble dans l’eau mais réagit facilement avec l’eau pour former de l’acide phosphorique.
Q : Combien de kilogrammes de P dans 14 % de P2O5 ?
R : Pour calculer la quantité de phosphore (P) dans 14 % de P2O5, multipliez le poids de l’engrais par 0,14.
