L’oxyde de magnésium (MgO) est un solide poudreux blanc utilisé comme matériau de construction et complément alimentaire. Il est également utilisé comme antiacide en raison de ses propriétés basiques (alcalines).
| Nom UICPA | L’oxyde de magnésium |
| Formule moléculaire | MgO |
| Numero CAS | 1309-48-4 |
| Synonymes | Magnésie, Magnésite, Périclase |
| InChI | InChI=1S/MgO/c1-2 |
Formule d’oxyde de magnésium
La formule chimique de l’oxyde de magnésium est MgO. Il représente un ion magnésium (Mg2+) et un ion oxygène (O2-). La formule indique le rapport des éléments présents dans le composé et est utilisée pour écrire des équations chimiques équilibrées pour les réactions impliquant l’oxyde de magnésium.
Oxyde De Magnésium Masse molaire
La masse molaire de l’oxyde de magnésium est de 40,304 g/mol. Il est calculé en additionnant les masses atomiques de chaque élément présent dans le composé. La masse atomique du magnésium est de 24,305 g/mol, tandis que celle de l’oxygène est de 16,000 g/mol. La masse molaire est importante pour déterminer la quantité de substance présente dans un échantillon donné d’oxyde de magnésium.
Point d’ébullition de l’oxyde de magnésium
Le point d’ébullition de l’oxyde de magnésium est de 2 852 °C. À cette température, la pression de vapeur du solide devient égale à la pression atmosphérique et il commence à bouillir. Le point d’ébullition élevé de l’oxyde de magnésium est dû à sa nature ionique, qui nécessite une grande quantité d’énergie pour séparer les ions dans la structure réticulaire.
Point de fusion de l’oxyde de magnésium
Le point de fusion de l’oxyde de magnésium est de 2 800 °C. A cette température, le solide change d’état en liquide. Le point de fusion élevé de l’oxyde de magnésium est également dû à sa nature ionique et aux fortes liaisons entre les ions dans la structure du réseau.
Densité d’oxyde de magnésium g/mL
La densité de l’oxyde de magnésium est de 3,58 g/mL. Cette valeur peut être utilisée pour déterminer la quantité d’espace occupée par une masse donnée d’oxyde de magnésium. C’est une propriété caractéristique du composé et est utile dans diverses applications.
Poids moléculaire de l’oxyde de magnésium
Le poids moléculaire de l’oxyde de magnésium est de 40,304 g/mol. C’est la somme des poids atomiques de chaque élément présent dans le composé. Le poids moléculaire est important pour déterminer la quantité de substance présente dans un échantillon donné d’oxyde de magnésium.
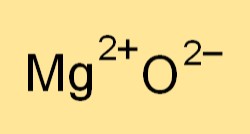
Structure de l’oxyde de magnésium
L’oxyde de magnésium a une structure de réseau cristallin dans laquelle les ions magnésium sont entourés d’ions oxygène. Les ions magnésium et oxygène sont maintenus ensemble par de fortes liaisons ioniques, qui contribuent aux points de fusion et d’ébullition élevés du composé. La structure cristalline est un facteur important pour déterminer les propriétés de l’oxyde de magnésium, telles que sa densité et sa conductivité thermique.
| Apparence | Solide poudreux blanc |
| Gravité spécifique | 3,58 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 40,304 g/mole |
| Densité | 3,58 g/ml |
| Point de fusion | 2800 °C |
| Point d’ébullition | 2852 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Soluble dans l’acide |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Alcaline (de base) |
Sécurité et dangers de l’oxyde de magnésium
L’oxyde de magnésium est généralement considéré comme sans danger pour la consommation humaine aux doses recommandées et est utilisé comme complément alimentaire et antiacide. Cependant, l’inhalation de concentrations élevées de poussière d’oxyde de magnésium peut provoquer une irritation respiratoire et une exposition à long terme peut entraîner des lésions pulmonaires. L’ingestion de grandes quantités d’oxyde de magnésium peut provoquer de la diarrhée, des nausées et des malaises abdominaux. Il est important de stocker l’oxyde de magnésium dans un endroit sec et bien ventilé pour éviter l’inhalation de poussière. Évitez tout contact cutané et oculaire avec l’oxyde de magnésium car cela pourrait provoquer une irritation. Comme pour tous les produits chimiques, il est important de suivre les procédures de manipulation et de sécurité appropriées lorsque vous travaillez avec de l’oxyde de magnésium afin de minimiser le risque de blessure.
| Symboles de danger | N / A |
| Description de la sécurité | S26-S36/37/39 |
| Numéros d’identification de l’ONU | UN3077, Substances dangereuses pour l’environnement, solides, nsa (oxyde de magnésium) |
| Code SH | 2825.90.90 |
| Classe de danger | 9 |
| Groupe d’emballage | III |
| Toxicité | Faible toxicité en cas d’ingestion aux doses recommandées, peut provoquer une irritation respiratoire en cas d’inhalation à fortes concentrations |
Méthodes de synthèse de l’oxyde de magnésium
L’oxyde de magnésium (MgO) peut être synthétisé par plusieurs méthodes, notamment la décomposition thermique, la précipitation et les procédés sol-gel.
La décomposition thermique, également connue sous le nom de calcination, consiste à chauffer du carbonate ou de l’hydroxyde de magnésium à des températures élevées pour produire du MgO. Cette méthode est couramment utilisée dans la production de matériaux réfractaires, ainsi que dans la synthèse de MgO de haute pureté destiné aux industries pharmaceutique et chimique.
La précipitation est une autre méthode de synthèse de MgO. Cette méthode implique la réaction de sels de magnésium, tels que le chlorure ou le sulfate de magnésium, avec une solution alcaline, telle que l’hydroxyde de sodium ou l’hydroxyde de potassium, pour former du MgO. Le MgO précipité peut ensuite être filtré, lavé et séché pour obtenir un produit pur.
Les procédés sol-gel impliquent l’hydrolyse et la condensation de précurseurs du magnésium, tels que les alcoolates de magnésium, pour former du MgO. Cette méthode offre l’avantage de produire du MgO avec une taille de particule uniforme et une structure cristalline bien définie, ce qui la rend utile pour les applications dans les industries des catalyseurs, de la céramique et de l’électronique.
Dans l’ensemble, la méthode de synthèse du MgO dépendra de la pureté, de la taille des particules et de la structure cristalline souhaitées, ainsi que de l’application prévue du produit MgO. Quelle que soit la méthode de synthèse, il est important de contrôler soigneusement les conditions de réaction pour éviter la formation d’impuretés et obtenir un produit MgO de haute qualité.
Utilisations de l’oxyde de magnésium
L’oxyde de magnésium (oxyde de magnésium) a un large éventail d’applications en raison de sa stabilité chimique, de sa conductivité thermique élevée et de ses propriétés d’isolation électrique. Certaines des utilisations les plus courantes de l’oxyde de magnésium comprennent :
- L’oxyde de magnésium (MgO) possède un large éventail d’utilisations en raison de sa stabilité chimique, de sa conductivité thermique élevée et de ses propriétés d’isolation électrique.
- Les industries du bâtiment et de la construction utilisent le MgO comme matériau résistant au feu et dans la production de matériaux réfractaires.
- L’industrie pharmaceutique utilise le MgO comme complément alimentaire et antiacide pour neutraliser l’acide gastrique.
- MgO sert de source de magnésium dans la production d’autres composés de magnésium, tels que l’hydroxyde de magnésium et le carbonate de magnésium.
- L’industrie chimique utilise le MgO comme catalyseur dans diverses réactions, notamment la production de caoutchouc synthétique, de plastiques et de résines.
- Les industries agricoles utilisent le MgO comme amendement du sol pour améliorer la fertilité des sols et fournir du magnésium essentiel à la croissance des plantes.
- La capacité du MgO à adsorber les métaux lourds et les substances toxiques le rend utile pour l’assainissement de l’environnement.
- L’industrie céramique utilise le MgO comme matière première dans la production de céramiques, d’isolateurs électriques, de matériaux réfractaires et d’isolations haute température.
- L’industrie électronique utilise le MgO dans la production de dispositifs électroniques tels que des condensateurs et des transistors en raison de sa constante diélectrique élevée et de sa faible tangente de perte.
Dans l’ensemble, l’oxyde de magnésium est un matériau polyvalent qui a de nombreuses applications en raison de sa combinaison unique de propriétés chimiques et physiques.
Des questions:
Qu’est-ce qui décrit le mieux un composé tel que l’oxyde de magnésium ?
L’oxyde de magnésium (MgO) se forme sous forme de composé ionique.
Le magnésium métallique donne des électrons à l’oxygène non métallique, créant des ions magnésium chargés positivement (Mg2+) et des ions oxyde chargés négativement (O2-). Ces ions se lient ioniquement par forte attraction électrostatique, ce qui donne lieu à une structure cristalline solide.
Les composés ioniques présentent des points de fusion et d’ébullition élevés, une solidité à température ambiante, une bonne conductivité électrique à l’état fondu ou dissous et une insolubilité dans la plupart des solvants. Ces caractéristiques différencient les composés ioniques des composés moléculaires, qui se forment par liaison covalente et présentent des points de fusion et d’ébullition plus bas, une mauvaise conductivité électrique et une solubilité dans de nombreux solvants.
Quel composé ionique est utilisé comme matériau de construction ? sel calcaire oxyde de magnésium oxyde de fer
Le calcaire salé n’est pas un composé ionique, mais l’oxyde de magnésium et l’oxyde de fer le sont.
L’oxyde de magnésium (MgO) et l’oxyde de fer sont utilisés comme matériaux de construction. Le MgO forme des murs et des cloisons ignifuges et sert de composant dans les matériaux réfractaires pour les applications à haute température. L’oxyde de fer, également connu sous le nom d’hématite, donne aux briques, au béton et à la céramique une couleur brun rougeâtre en tant que pigment. L’hématite agit également comme catalyseur dans les réactions chimiques et sert de matériau magnétique dans diverses technologies.
