L’oxyde de lithium (Li2O) est un composé formé de lithium et d’oxygène. Il présente de fortes propriétés ioniques et est largement utilisé dans les batteries en raison de son potentiel électrochimique élevé.
| Nom UICPA | Oxyde de lithium |
| Formule moléculaire | Li2O |
| Numero CAS | 12142-77-7 |
| Synonymes | Oxyde de lithium(I); Oxyde de dilithium ; Lithia ; Oxolithium ; UNII-06T3K8P3KU |
| InChI | InChI=1S/2Li.O |
Formule d’oxyde de lithium
Formule d’oxyde de lithium
La formule chimique de l’oxyde de dilithium est Li2O. Il représente la combinaison de deux atomes de lithium (Li) et d’un atome d’oxygène (O). Ce composé simple et stable est essentiel dans diverses applications industrielles.
Oxyde De Lithium Masse molaire
La masse molaire du Li2O est d’environ 29,88 g/mol. Il est calculé en additionnant les masses atomiques de deux atomes de lithium (6,94 g/mol chacun) et d’un atome d’oxygène (16,00 g/mol).
Point d’ébullition de l’oxyde de lithium
L’oxyde de dilithium a un point d’ébullition impressionnant d’environ 2 463 degrés Celsius (4 465 degrés Fahrenheit). Ce point d’ébullition exceptionnellement élevé le rend utile dans les industries nécessitant une résistance extrême à la chaleur.
Point de fusion de l’oxyde de lithium
Le point de fusion de l’oxyde de dilithium est d’environ 1 450 degrés Celsius (2 642 degrés Fahrenheit). Lorsqu’il est exposé à cette température, il passe de l’état solide à l’état liquide, facilitant ainsi divers processus de fabrication.
Densité d’oxyde de lithium g/mL
L’oxyde de dilithium a une densité d’environ 2,01 g/mL. Cette valeur représente la masse du composé par unité de volume et est essentielle pour déterminer ses propriétés et ses applications.
Poids moléculaire de l’oxyde de lithium
Le poids moléculaire du Li2O est de 29,88 g/mol. C’est la somme des poids atomiques de ses éléments constitutifs, le lithium et l’oxygène. Cette valeur facilite les calculs stœchiométriques.
Structure de l’oxyde de lithium
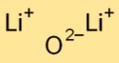
L’oxyde de dilithium a une structure cristalline ionique simple. Il est constitué de cations lithium (Li+) et d’anions oxydes (O2-) maintenus ensemble par de fortes forces électrostatiques. Cette disposition contribue à sa stabilité et à sa conductivité.
Solubilité de l’oxyde de lithium
L’oxyde de dilithium présente une faible solubilité dans l’eau. Il réagit avec l’eau pour former de l’hydroxyde de lithium, limitant sa dissolution. Cependant, il présente une certaine solubilité dans certains solvants non aqueux et sels fondus.
En conclusion, l’oxyde de dilithium est un composé important aux caractéristiques et applications diverses. Sa structure stable, ses points de fusion et d’ébullition élevés le rendent précieux dans des industries telles que la céramique, la fabrication du verre et comme composant de batteries spécialisées. Comprendre ses propriétés nous permet d’exploiter son potentiel à diverses fins.
| Apparence | Solide blanc |
| Gravité spécifique | 2,01 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 29,88 g/mole |
| Densité | 2,01 g/ml |
| Point de fusion | 1 450 °C (2 642 °F) |
| Point d’ébullition | 2 463 °C (4 465 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit avec l’eau |
| Solubilité | Mauvaise solubilité dans l’eau, forme de l’hydroxyde de lithium |
| La pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Veuillez noter que certaines propriétés telles que le point d’éclair, la pression de vapeur, la densité de vapeur, le pKa et le pH ne sont pas applicables ou ne sont pas disponibles pour le Li2O en raison de sa nature chimique et de son comportement.
Sécurité et dangers de l’oxyde de lithium
L’oxyde de dilithium pose certains problèmes de sécurité et dangers. Il réagit fortement avec l’eau, produisant de l’hydroxyde de lithium, qui est caustique et peut provoquer une irritation de la peau et des yeux. L’inhalation de ses poussières ou de ses fumées peut entraîner une irritation respiratoire. Le composé n’est pas classé comme hautement toxique mais doit être manipulé avec précaution pour éviter tout contact avec la peau ou les yeux. Une ventilation adéquate et un équipement de protection individuelle sont essentiels lorsque l’on travaille avec de l’oxyde de dilithium. En cas d’ingestion accidentelle, des soins médicaux immédiats sont nécessaires. De plus, il doit être stocké à l’écart des substances incompatibles pour éviter tout risque potentiel d’incendie ou d’explosion.
| Symboles de danger | Corrosif |
| Description de la sécurité | Réagit avec l’eau. Provoque une irritation de la peau et des yeux. Manipuler avec soin. Eviter l’inhalation de poussières ou de fumées. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 2825.70.00 |
| Classe de danger | 8 (Substances corrosives) |
| Groupe d’emballage | III |
| Toxicité | Pas très toxique, mais prudence requise. Évitez l’ingestion et le contact avec la peau ou les yeux. |
Méthodes de synthèse de l’oxyde de lithium
Diverses méthodes permettent la synthèse de l’oxyde de dilithium.
Une approche courante implique la réaction du lithium métallique avec l’oxygène ou l’air à haute température. Dans ce processus, l’oxygène gazeux facilite le chauffage du lithium métallique, entraînant la formation d’oxyde de dilithium.
Une autre méthode est la décomposition thermique des sels de lithium, tels que le carbonate de lithium ou l’hydroxyde de lithium , à des températures élevées. En soumettant ces sels à la chaleur, ils se décomposent pour donner de l’oxyde de dilithium.
De plus, pour produire de l’oxyde de dilithium, on peut utiliser l’hydroxyde de lithium comme précurseur. Il est d’abord déshydraté par chauffage, le transformant en la forme d’oxyde souhaitée.
Une autre technique implique l’utilisation de minéraux ou de minerais contenant du lithium. Les processus chimiques extraient les composés du lithium de ces sources naturelles, qui, à leur tour, subissent un traitement ultérieur pour produire de l’oxyde de dilithium.
Il est essentiel de noter que chaque méthode de synthèse peut présenter des avantages et des défis spécifiques en termes de coût, d’efficacité et de pureté. Les scientifiques et les ingénieurs tiennent compte de ces facteurs lorsqu’ils sélectionnent la méthode la plus appropriée pour produire de l’oxyde de dilithium afin de répondre à des exigences industrielles ou de recherche spécifiques.
Utilisations de l’oxyde de lithium
L’oxyde de dilithium (Li2O) trouve des applications polyvalentes dans diverses industries en raison de ses propriétés uniques. Voici quelques utilisations clés :
- Industrie céramique : L’oxyde de dilithium est un composant crucial des céramiques, améliorant leur résistance mécanique et leur stabilité thermique. Il réduit également la température de cuisson, économisant ainsi de l’énergie pendant le processus de fabrication.
- Production de verre : Dans l’industrie du verre, l’oxyde de dilithium agit comme un fondant, abaissant la température de fusion du verre et améliorant sa résistance aux attaques chimiques, ce qui donne des produits en verre de haute qualité.
- Technologie des batteries : L’oxyde de dilithium sert de précurseur dans la production de batteries lithium-ion. Il contribue aux matériaux cathodiques de la batterie, améliorant ainsi sa capacité de stockage d’énergie et ses performances globales.
- Déshydratant : La forte affinité de l’oxyde de dilithium pour l’eau en fait un dessicant efficace, utilisé pour éliminer l’humidité de certains environnements, comme dans les systèmes de climatisation et de purification de gaz.
- Métallurgie : Dans les processus métallurgiques, l’oxyde de dilithium facilite le raffinage des métaux en éliminant les impuretés.
- Verres spéciaux : La production de verres spéciaux pour diverses applications, telles que l’optique, l’électronique et les instruments scientifiques, implique l’utilisation d’oxyde de dilithium.
- Catalyseur : L’oxyde de dilithium sert de catalyseur dans certaines réactions chimiques, facilitant la transformation des réactifs en produits souhaités.
- Industrie nucléaire : Dans l’industrie nucléaire, l’oxyde de dilithium fonctionne comme un modérateur de neutrons, contrôlant la vitesse des réactions de fission nucléaire.
La diversité des applications met en évidence l’importance de l’oxyde de dilithium dans l’avancement de la technologie, de la fabrication et de la recherche scientifique. Ses propriétés uniques continuent de stimuler l’innovation dans diverses industries, ce qui en fait un composé précieux doté d’un large éventail d’utilisations pratiques.
Des questions:
Q : Quelle équation montre que l’oxyde de lithium est formé à partir de la réaction entre l’oxygène et le lithium ?
A : 4Li + O2 → 2Li2O
Q : Quelle est la masse molaire de l’oxyde de lithium, Li2O ?
R : La masse molaire du Li2O est d’environ 29,88 g/mol.
Q : Quelle est la formule de l’oxyde de lithium ?
R : La formule de l’oxyde de dilithium est Li2O.
Q : L’oxyde de lithium est-il ionique ou covalent ?
R : L’oxyde de dilithium est ionique.
Q : Quel est le nombre d’oxydation du lithium dans une liaison ionique ?
R : Le nombre d’oxydation du lithium dans une liaison ionique est de +1.
Q : Numéro de coordination du lithium dans Li2O ?
R : Le nombre de coordination du lithium dans Li2O est 4.
Q : Le Li2O est-il ionique ou covalent ?
R : Li2O est ionique.
Q : Laquelle des réactions suivantes est associée à l’énergie de réseau du Li2O (ΔH°latt) ?
A : La réaction : Li+(g) + O2-(g) → Li2O(s)
Q : Quelle est la masse molaire de l’oxyde de lithium, Li2O ?
R : La masse molaire du Li2O est d’environ 29,88 g/mol.
Q : Lequel des éléments suivants sera produit lors de la combustion du lithium métal (Li) ? O2, LiO, H2O, Li2O ?
R : Le Li2O sera produit lors de la combustion du lithium métallique (Li).
Q : Combien de grammes contiennent 4,5 moles de Li2O ?
R : Il y a environ 134,46 grammes dans 4,5 moles de Li2O.
