L’oxyde de bore (B2O3) est un composé formé par la liaison chimique du bore et de l’oxygène. Il est utilisé dans la production de verre et de céramique en raison de son point de fusion élevé.
| Nom UICPA | Oxyde de bore |
| Formule moléculaire | B2O3 |
| Numero CAS | 1303-86-2 |
| Synonymes | Trioxyde de tribore, oxyde borique, oxyde de bore (III) |
| InChI | InChI=1S/B2O3/c3-1-5-2(4)6-1 |
Propriétés de l’oxyde de bore
Formule d’oxyde de bore
La formule chimique de l’oxyde borique est B2O3. Il représente le rapport entre les atomes de bore et les atomes d’oxygène dans le composé. Les numéros d’indice indiquent qu’il y a deux atomes de bore et trois atomes d’oxygène présents dans chaque molécule d’oxyde borique.
Oxyde De Bore Masse molaire
La masse molaire de l’oxyde borique peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le bore a une masse atomique de 10,81 g/mol, tandis que l’oxygène a une masse atomique de 16,00 g/mol. En multipliant les masses atomiques par le nombre respectif d’atomes et en les additionnant, la masse molaire de l’oxyde borique est déterminée à 69,62 g/mol.
Point d’ébullition de l’oxyde de bore
L’oxyde borique a un point d’ébullition élevé d’environ 1 860 degrés Celsius. Cela signifie qu’à pression atmosphérique normale, il faut une énergie importante pour convertir l’oxyde borique de son état liquide à son état gazeux.
Point de fusion de l’oxyde de bore
Le point de fusion de l’oxyde borique est d’environ 450 degrés Celsius. À cette température, l’oxyde borique solide passe à l’état liquide. Son point de fusion relativement bas le rend adapté à diverses applications industrielles.
Densité d’oxyde de bore g/mL
L’oxyde borique présente une densité d’environ 2,46 g/mL. La densité fait référence à la masse par unité de volume d’une substance. La densité de l’oxyde borique indique qu’il est relativement dense, lui permettant de couler dans la plupart des liquides.
Poids moléculaire de l’oxyde de bore
Le poids moléculaire de l’oxyde borique, également appelé masse molaire, est de 69,62 g/mol. Cette valeur représente la masse d’une mole du composé et est utile pour calculer la quantité d’oxyde borique dans un échantillon donné.
Structure de l’oxyde de bore
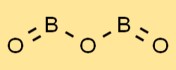
L’oxyde borique a une structure unique, comportant un réseau d’unités BO3 planaires trigonales. Les atomes de bore sont entourés de trois atomes d’oxygène disposés triangulairement. Cette disposition confère à l’oxyde borique ses propriétés caractéristiques et sa stabilité.
Solubilité de l’oxyde de bore
L’oxyde borique est insoluble dans l’eau et la plupart des solvants organiques. Sa solubilité est limitée dans les acides tels que l’acide sulfurique et l’acide chlorhydrique. Cette faible solubilité contribue à sa stabilité et à son utilité dans diverses applications, telles que la production de verre et de céramique.
| Apparence | Solide blanc |
| Gravité spécifique | 2,46 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 69,62 g/mole |
| Densité | 2,46 g/ml |
| Point de fusion | 450°C |
| Point d’ébullition | 1 860 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Solubilité limitée dans les acides, tels que l’acide sulfurique et l’acide chlorhydrique |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Veuillez noter que certaines propriétés telles que le point d’éclair, la pression de vapeur, la densité de vapeur, le pKa et le pH ne sont pas applicables ou n’ont pas été signalées pour l’oxyde borique.
Sécurité et dangers de l’oxyde de bore
L’oxyde borique pose certaines considérations de sécurité et de danger. Le contact direct avec de la poudre ou de la poussière d’oxyde borique peut irriter la peau, les yeux et le système respiratoire. Il est important de le manipuler avec précaution et d’utiliser des équipements de protection individuelle appropriés tels que des gants et des lunettes. L’inhalation de particules d’oxyde borique peut provoquer une irritation respiratoire, il est donc conseillé de travailler dans des zones bien ventilées. En cas d’ingestion accidentelle, des soins médicaux doivent être immédiatement recherchés. L’oxyde borique est ininflammable et ne possède pas de point d’éclair. Comme pour toute substance chimique, il est recommandé de suivre les directives appropriées de manipulation et de stockage pour garantir une utilisation sûre.
| Symboles de danger | Non classés |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Utiliser dans un endroit bien ventilé. Portez un équipement de protection. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 2810.00.2000 |
| Classe de danger | Non classés |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Toxicité faible à modérée. Peut provoquer une irritation par contact ou par inhalation. |
Veuillez noter que l’oxyde borique ne porte pas de symboles de danger, d’identification ONU, de classe de danger ou de groupe d’emballage. Il est important de suivre les directives et pratiques générales de sécurité lors de la manipulation et de l’utilisation de l’oxyde borique afin de minimiser le risque d’exposition et de garantir une utilisation sûre.
Méthodes de synthèse de l’oxyde de bore
Diverses méthodes permettent la synthèse de l’oxyde borique. Une approche largement utilisée consiste à chauffer le bore élémentaire en présence d’oxygène ou d’air pour créer de l’oxyde borique. Une autre méthode consiste à faire réagir des halogénures de bore, tels que le trichlorure de bore (BCl3) ou le tribromure de bore (BBr3), avec de l’eau, entraînant la formation d’oxyde borique.
De plus, les composés contenant du bore comme le nitrure de bore ou le trisulfure de bore peuvent subir une hydrolyse avec de l’eau pour produire de l’oxyde borique. La décomposition thermique des borates, tels que le borate de sodium ou le borax , lorsqu’ils sont soumis à la chaleur, produit également de l’oxyde borique.
Il est important de noter que le choix d’une méthode de synthèse spécifique dépend de la pureté, de la quantité et de l’application souhaitées de l’oxyde borique. Chaque méthode présente des avantages et peut convenir à différentes situations.
Utilisations de l’oxyde de bore
L’oxyde borique trouve diverses applications dans diverses industries. Voici quelques-unes de ses utilisations :
- Production de verre et de céramique : L’oxyde borique est un ingrédient clé dans la fabrication du verre et de la céramique. Il confère aux produits en verre des propriétés souhaitables telles que la résistance thermique, la transparence et la durabilité.
- Ignifugeants : les fabricants utilisent l’oxyde borique comme ignifuge dans des matériaux tels que les textiles, les plastiques et les produits en bois. L’oxyde borique réduit l’inflammabilité de ces matériaux, garantissant ainsi une sécurité accrue.
- Verre borosilicaté : L’oxyde borique joue un rôle essentiel en tant que composant du verre borosilicaté, réputé pour sa faible dilatation thermique et sa haute résistance à la chaleur. Les industries utilisent ce type de verre dans les équipements de laboratoire, les ustensiles de cuisine et les appareils optiques haut de gamme.
- Fibres spécialisées : La production de fibres spécialisées, notamment les fibres de bore et les fibres de nitrure de bore, intègre l’utilisation d’oxyde borique. Ces fibres possèdent des propriétés mécaniques et thermiques exceptionnelles, ce qui les rend adaptées aux industries aérospatiale, automobile et de haute technologie.
- Produits chimiques à base de bore : L’oxyde borique sert de précurseur pour la synthèse de divers produits chimiques à base de bore, tels que les borates et les hydrures de bore. Ces produits chimiques trouvent des applications dans l’agriculture, les produits pharmaceutiques et les systèmes de stockage d’énergie.
- Flux et agents de soudage : L’oxyde borique réduit le point de fusion des matériaux et améliore leur fluidité, ce qui en fait un flux efficace dans les processus métallurgiques. Il améliore la liaison des surfaces métalliques lorsqu’il est utilisé comme agent de soudage.
- Catalyseurs : Les réactions chimiques bénéficient des catalyseurs à base d’oxyde borique, car ils favorisent les réactions souhaitables et augmentent les vitesses de réaction.
- Industrie des semi-conducteurs : l’oxyde borique joue un rôle crucial dans la production de semi-conducteurs. Il agit comme un matériau dopant pour modifier activement les propriétés électriques du silicium.
La large gamme d’applications de l’oxyde borique met en valeur sa polyvalence et son importance dans diverses industries, contribuant aux progrès de la technologie, de la sécurité et de la science des matériaux.
Des questions:
Q : Quel est l’état d’oxydation du bore dans le B2O3 ?
R : L’état d’oxydation du bore dans B2O3 est +3.
Q : Quelle est la formule empirique de l’oxyde de bore ?
R : La formule empirique de l’oxyde borique est B2O3.
Q : Quand la concentration en surface du bore affectera-t-elle le taux de croissance de l’oxyde ?
R : La concentration superficielle du bore affectera le taux de croissance de l’oxyde lorsqu’il agit comme dopant ou catalyseur dans le processus d’oxydation.
Q : Qu’est-ce que l’oxyde de bore boria ?
R : L’oxyde borique, également connu sous le nom de boria, est un composé de formule chimique B2O3.
Q : Quel est l’indice d’oxydation du bore ?
R : Le bore a généralement un indice d’oxydation de +3.
Q : Le bore ralentira-t-il l’oxydation dans les matériaux privés d’oxygène ?
R : Le bore ne ralentit pas l’oxydation dans les matériaux privés d’oxygène, car il a besoin d’oxygène pour former de l’oxyde borique.
Q : Quel est l’état d’oxydation du bore dans HBO2 dans CuO ?
R : L’état d’oxydation du bore dans HBO2 est +3.
Q : Combien de moles de B2O3 peuvent être formées ?
R : Le nombre de moles de B2O3 formées dépend de la quantité de réactifs utilisés dans la réaction.
Q : Le B2O3 est-il ionique ou moléculaire ?
R : B2O3 est un composé ionique.
Q : Quelle paire est répertoriée par ordre de basicité croissante ? PBO < SiO2 B2O3 < Li2O
R : La paire répertoriée par ordre de basicité croissante est B2O3 < Li2O < PBO < SiO2.
Q : B2H6 + O2 → B2O3 + H2O, cette équation est-elle équilibrée ?
R : Non, l’équation n’est pas équilibrée. Cela nécessite des ajustements pour parvenir à une équation équilibrée.
Q : Quelle quantité de bore peut-on obtenir à partir de 210,0 livres de B2O3 ?
R : La quantité de bore obtenue à partir de 210,0 livres de B2O3 dépend de la masse molaire et de la stœchiométrie de la réaction.
