L’oxyde d’argent (Ag2O) est un composé chimique composé d’argent et d’oxygène. Il est couramment utilisé comme agent oxydant et catalyseur dans diverses réactions chimiques.
| Nom UICPA | Oxyde d’argent (I) |
| Formule moléculaire | Ag2O |
| Numero CAS | 11113-88-5 |
| Synonymes | Monoxyde d’argent ; Oxyde d’argent (1+); Dioxoargent; Oxyde argenté, diargent; oxygène (2-) |
| InChI | InChI=1S/2Ag.O |
Propriétés de l’oxyde d’argent
Formule d’oxyde d’argent
La formule du monoxyde d’argent est Ag2O. Il se compose de deux atomes d’argent (Ag) liés à un atome d’oxygène (O). Cette formule représente le rapport des éléments présents dans le composé.
Oxyde D’argent Masse molaire
La masse molaire du monoxyde d’argent est calculée en additionnant les masses atomiques de ses éléments constitutifs. L’argent a une masse atomique de 107,87 g/mol et l’oxygène a une masse atomique de 16,00 g/mol. La masse molaire du monoxyde d’argent est donc d’environ 231,87 g/mol.
Point d’ébullition de l’oxyde d’argent
Le monoxyde d’argent n’a pas de point d’ébullition distinct car il se décompose avant d’atteindre son point d’ébullition. Lorsqu’il est chauffé, il subit une réaction chimique et se décompose en argent métallique et en oxygène gazeux.
Point de fusion de l’oxyde d’argent
Le monoxyde d’argent a un point de fusion d’environ 280 °C (536 °F). À cette température, le monoxyde d’argent solide se transforme en état liquide. Le point de fusion indique la température à laquelle la forme solide passe à la forme liquide.
Densité d’oxyde d’argent g/mL
La densité du monoxyde d’argent est d’environ 7,14 g/mL. Cette valeur représente la masse du composé par unité de volume. La haute densité du monoxyde d’argent est attribuée à la lourde masse atomique de l’argent.
Poids moléculaire de l’oxyde d’argent
Le poids moléculaire du monoxyde d’argent est calculé en additionnant les masses atomiques de ses éléments constitutifs. Le poids moléculaire de Ag2O est d’environ 231,87 g/mol. Il fournit des informations sur la masse d’une mole du composé.
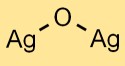
Structure d’oxyde d’argent
Le monoxyde d’argent a une structure cristalline. Les atomes d’argent et d’oxygène sont disposés selon un motif en forme de treillis. La structure est constituée de cations Ag^+ et d’anions O^2- maintenus ensemble par des liaisons ioniques.
Solubilité de l’oxyde d’argent
Le monoxyde d’argent est peu soluble dans l’eau. Il se dissout dans une certaine mesure, produisant de l’hydroxyde d’argent (AgOH). La solubilité du monoxyde d’argent peut être améliorée en utilisant des solutions acides ou alcalines, qui le transforment en sels d’argent solubles.
| Apparence | Solide noir ou marron foncé |
| Gravité spécifique | 7,14 g/cm³ |
| Couleur | Noir |
| Odeur | Inodore |
| Masse molaire | 231,87 g/mole |
| Densité | 7,14 g/cm³ |
| Point de fusion | 280 °C (536 °F) |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Peu soluble |
| Solubilité | Soluble dans les solutions acides ou alcalines |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers de l’oxyde d’argent
Lorsque vous manipulez du monoxyde d’argent, prenez des précautions pour assurer votre sécurité. L’avaler ou l’inhaler peut être nocif et irriter la peau, les yeux et le système respiratoire. Assurer une ventilation adéquate pour éviter l’accumulation de poussière ou de fumées. Portez des équipements de protection comme des gants et des lunettes pour minimiser le contact avec le composé. Conservez le monoxyde d’argent dans un endroit frais et sec, à l’écart des matériaux inflammables et des substances incompatibles. En cas d’ingestion, d’inhalation ou de contact avec la peau, consulter immédiatement un médecin. Suivre les procédures de manipulation et d’élimination appropriées pour éviter la contamination de l’environnement.
| Symboles de danger | Aucun |
| Description de la sécurité | Nocif en cas d’ingestion ou d’inhalation. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 2841.90.90 |
| Classe de danger | Non classés |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Toxicité modérée |
Méthodes de synthèse de l’oxyde d’argent
Il existe plusieurs méthodes pour synthétiser le monoxyde d’argent.
Une approche courante implique la réaction entre un sel d’argent soluble, tel que le nitrate d’argent (AgNO3) et un hydroxyde alcalin, tel que l’hydroxyde de sodium (NaOH) . La réaction se déroule en mélangeant des solutions aqueuses de sel d’argent et d’hydroxyde alcalin, ce qui entraîne la formation d’un précipité de monoxyde d’argent. Récupérer le précipité et le sécher pour obtenir du monoxyde d’argent solide.
Une autre méthode implique la décomposition thermique d’un composé d’argent, tel que le nitrate d’argent ou le carbonate d’argent. Chauffez le composé à une température spécifique pour former du monoxyde d’argent comme produit. Le processus de décomposition libère du dioxyde d’azote (NO2) ou du dioxyde de carbone (CO2) selon le composé de départ utilisé.
Utiliser l’électrolyse pour synthétiser le monoxyde d’argent. Cette méthode consiste à faire passer un courant électrique à travers une électrode d’argent immergée dans une solution électrolytique appropriée, contenant souvent du nitrate d’argent. L’oxydation de l’électrode d’argent se produit, entraînant la formation de monoxyde d’argent à la surface de l’électrode.
Il convient de noter que le choix de la méthode de synthèse dépend de facteurs tels que la pureté souhaitée, le rendement et l’application spécifique du monoxyde d’argent. Suivez les précautions de sécurité appropriées pendant la synthèse, notamment en utilisant un équipement de protection approprié et en respectant les procédures recommandées.
Utilisations de l’oxyde d’argent
Le monoxyde d’argent a diverses applications en raison de ses propriétés uniques. Voici quelques utilisations du monoxyde d’argent :
- Agent oxydant : Les réactions de synthèse organique utilisent généralement le monoxyde d’argent comme agent oxydant pour convertir les alcools en aldéhydes ou en cétones.
- Catalyseur : Le monoxyde d’argent agit comme un catalyseur dans diverses réactions chimiques, notamment l’oxydation des alcènes et des aldéhydes et la réduction des composés nitro.
- Piles : les piles bouton utilisent du monoxyde d’argent comme matériau de cathode en raison de sa densité énergétique et de sa stabilité élevées.
- Agent antimicrobien : le monoxyde d’argent présente des propriétés antimicrobiennes, ce qui le rend utile dans des applications telles que les pansements, les dispositifs médicaux et les systèmes de purification d’eau.
- Pâte conductrice : La production de produits électroniques, notamment de cartes de circuits imprimés et de résistances à couche épaisse, utilise du monoxyde d’argent dans des pâtes conductrices.
- Industrie photographique : L’industrie photographique utilise le monoxyde d’argent pour ses propriétés sensibles à la lumière, en particulier dans la photographie en noir et blanc.
- Pyrotechnie : les mélanges pyrotechniques utilisent du monoxyde d’argent pour produire des effets et des couleurs spéciaux dans les feux d’artifice.
- Réactifs chimiques : les laboratoires utilisent le monoxyde d’argent comme réactif chimique pour diverses procédures analytiques et synthétiques.
- Fabrication du verre : les verres spéciaux, tels que les revêtements miroir, utilisent du monoxyde d’argent en raison de ses propriétés réfléchissantes.
- Placage d’argent : les applications de placage d’argent utilisent parfois du monoxyde d’argent pour fournir un revêtement durable et résistant à la corrosion.
Ces diverses applications mettent en évidence la polyvalence et l’importance du monoxyde d’argent dans diverses industries.
Des questions:
Q : L’Ag2O est-il soluble dans l’eau ?
R : Ag2O est peu soluble dans l’eau.
Q : Combien de grammes d’Ag2O se seraient décomposés si 4,58 L d’O2 étaient formés à P=745 mmHg et T=308K ?
R : La masse d’Ag2O décomposé peut être calculée à l’aide de la stœchiométrie et de la loi des gaz parfaits.
Q : Ag2O est-il ionique ?
R : Oui, Ag2O est un composé ionique.
Q : Pourquoi est-il appelé oxyde d’argent et non oxyde de désargent ?
R : La convention de dénomination des composés ioniques binaires n’utilise pas de préfixes comme « di- ». C’est pourquoi on l’appelle oxyde d’argent.
Q : Quel disaccharide ne peut pas réagir avec Ag2O ?
R : Ag2O ne réagit pas avec les disaccharides car il est principalement utilisé comme agent oxydant en synthèse organique.
Q : Qu’est-ce que l’oxyde d’argent ?
R : Le monoxyde d’argent (Ag2O) est un composé chimique composé d’argent et d’oxygène, souvent utilisé comme agent oxydant et catalyseur.
Q : L’alcalin et l’oxyde d’argent peuvent-ils être utilisés de manière interchangeable ?
R : L’alcalin et l’oxyde d’argent peuvent ne pas être interchangeables car ils ont des propriétés chimiques et des applications différentes.
Q : Combien de moles d’argent seraient déposées si 0,632 mole de plomb était oxydée en nitrate de plomb(II) ?
R : La stœchiométrie de l’équation équilibrée déterminerait le nombre de moles d’argent déposées.
Q : Combien de temps dure l’argent oxydé ?
R : Divers facteurs tels que les conditions environnementales et l’entretien déterminent la longévité de l’argent oxydé, mais des soins appropriés peuvent le préserver pendant de longues périodes.
