L’oxychlorure de phosphore (POCl3) est un composé chimique utilisé dans divers procédés industriels. Il réagit avec l’eau pour former de l’acide phosphorique et de l’acide chlorhydrique.
| Nom UICPA | Oxychlorure de phosphore |
| Formule moléculaire | POCl3 |
| Numero CAS | 10025-87-3 |
| Synonymes | Chlorure de phosphoryle, trichlorure de phosphoryle, trichlorure de phosphore |
| InChI | InChI=1S/Cl3OP/c1-4(2)3 |
Propriétés de l’oxychlorure de phosphore
Formule d’oxychlorure de phosphore
La formule chimique du chlorure de phosphoryle est POCl3. Il est constitué d’un atome de phosphore (P), symbolisé par P, et de trois atomes de chlore (Cl), symbolisés par Cl. La formule indique le rapport de chaque élément présent dans le composé.
Oxychlorure De Phosphore Masse molaire
La masse molaire du chlorure de phosphoryle peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le phosphore a une masse molaire de 30,97 g/mol, tandis que le chlore a une masse molaire de 35,45 g/mol. En multipliant la masse molaire du chlore par 3 et en ajoutant la masse molaire du phosphore, on obtient une masse molaire totale d’environ 153,33 g/mol pour le chlorure de phosphoryle.
Point d’ébullition de l’oxychlorure de phosphore
Le chlorure de phosphoryle a un point d’ébullition d’environ 105,5°C. Cette température représente le point auquel le composé liquide passe à l’état gazeux sous pression atmosphérique standard. Le point d’ébullition est une caractéristique importante qui affecte la manipulation et l’application du chlorure de phosphoryle.
Oxychlorure de phosphore Point de fusion
Le point de fusion du chlorure de phosphoryle est d’environ -112,5°C. Cela signifie la température à laquelle le composé solide passe à l’état liquide. Le point de fusion est un paramètre critique pour les considérations de stockage et de transport.
Densité d’oxychlorure de phosphore g/mL
La densité du chlorure de phosphoryle est d’environ 1,65 g/mL. La densité fait référence à la quantité de masse par unité de volume d’une substance. Une densité plus élevée suggère une plus grande concentration de particules dans un volume donné.
Oxychlorure De Phosphore Poids moléculaire
Le poids moléculaire du chlorure de phosphoryle est calculé en additionnant les masses atomiques de ses éléments constitutifs. Le poids moléculaire du phosphore est d’environ 30,97 g/mol, tandis que le chlore a un poids moléculaire de 35,45 g/mol. L’addition des masses pondérées donne un poids moléculaire approximatif de 153,33 g/mol pour le chlorure de phosphoryle.
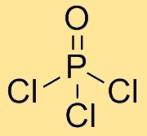
Structure de l’oxychlorure de phosphore
Le chlorure de phosphoryle a une structure moléculaire dans laquelle un atome de phosphore est lié à trois atomes de chlore et à un atome d’oxygène. Les atomes de chlore sont disposés symétriquement autour de l’atome central de phosphore, l’atome d’oxygène étant également lié à l’atome de phosphore. Cet agencement forme une géométrie tétraédrique.
Solubilité de l’oxychlorure de phosphore
Le chlorure de phosphoryle est peu soluble dans l’eau mais se dissout facilement dans les solvants organiques tels que le benzène, le tétrachlorure de carbone et le chloroforme. Son comportement de solubilité est attribué à la nature polaire de la molécule et à la présence d’atomes électronégatifs comme l’oxygène et le chlore.
| Apparence | Liquide incolore |
| Gravité spécifique | 1,645 g/ml |
| Couleur | Incolore |
| Odeur | Âcre |
| Masse molaire | 153,33 g/mole |
| Densité | 1,645 g/ml |
| Point de fusion | -112,5°C |
| Point d’ébullition | 105,5°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit vigoureusement |
| Solubilité | Soluble dans les solvants organiques tels que le benzène, le tétrachlorure de carbone et le chloroforme |
| La pression de vapeur | 11 mmHg à 20°C |
| Densité de vapeur | 5,29 (Air = 1) |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers de l’oxychlorure de phosphore
Le chlorure de phosphoryle présente des risques pour la sécurité et nécessite une manipulation prudente. Il est corrosif pour la peau, les yeux et le système respiratoire. Le contact peut provoquer de graves brûlures et des lésions oculaires. L’inhalation de ses fumées ou vapeurs peut irriter les voies respiratoires. Un équipement de protection individuelle approprié, tel que des gants et des lunettes, doit être porté lorsque vous travaillez avec ce composé. Il doit être stocké dans un endroit bien ventilé, loin des sources d’ignition. En cas d’exposition, des soins médicaux immédiats sont nécessaires. De plus, il doit être manipulé sous une sorbonne pour éviter le dégagement de vapeurs toxiques.
| Symboles de danger | Corrosif, Danger |
| Description de la sécurité | Corrosif. Provoque de graves brûlures de la peau et des lésions oculaires. Peut être nocif en cas d’inhalation ou d’ingestion. Eviter le contact et l’inhalation. |
| Numéros d’identification de l’ONU | ONU 1810 |
| Code SH | 2812.10.00 |
| Classe de danger | Classe 8 (substances corrosives) |
| Groupe d’emballage | Groupe d’emballage III (danger mineur) |
| Toxicité | Le chlorure de phosphoryle est toxique et peut avoir de graves effets sur la santé. |
Méthodes de synthèse de l’oxychlorure de phosphore
Le chlorure de phosphoryle peut être synthétisé par diverses méthodes. Une méthode courante implique la réaction entre le trichlorure de phosphore (PCl3) et l’oxygène (O2). Dans ce processus, PCl3 est chauffé en présence d’un excès d’oxygène pour former du chlorure de phosphoryle. La réaction est exothermique et se produit généralement dans un environnement contrôlé, tel qu’une cuve de réacteur.
Une autre méthode de synthèse implique la réaction entre le pentoxyde de phosphore (P2O5) et le trichlorure de phosphore. P2O5 agit comme agent déshydratant et, lorsqu’il est combiné avec PCl3 , il forme du chlorure de phosphoryle.
De plus, le chlorure de phosphoryle peut être synthétisé par la réaction du tribromure de phosphore (PBr3) et du pentoxyde de phosphore. Cette réaction conduit à la formation de chlorure de phosphoryle et de pentabromure de phosphore.
De plus, la chloration directe du phosphore peut également produire du chlorure de phosphoryle. Dans ce processus, du chlore gazeux passe sur du phosphore chauffé, entraînant la formation de chlorure de phosphoryle.
Il est important de noter que ces méthodes de synthèse doivent être effectuées avec prudence en raison de la réactivité et de la nature dangereuse des composés impliqués. Des protocoles de sécurité appropriés, y compris l’utilisation d’équipements de protection et des conditions de réaction contrôlées, doivent être suivis pour garantir une manipulation et une synthèse sûres du chlorure de phosphoryle.
Utilisations de l’oxychlorure de phosphore
Le chlorure de phosphoryle trouve diverses applications dans différentes industries en raison de ses propriétés uniques. Voici quelques utilisations courantes :
- Synthèse chimique : la chimie organique utilise largement le chlorure de phosphoryle comme réactif polyvalent pour produire divers composés, notamment des acides phosphoniques, des esters et des amides.
- Produits agrochimiques : La synthèse de pesticides et d’herbicides dans la protection des cultures et la lutte antiparasitaire repose sur le chlorure de phosphoryle comme ingrédient clé, jouant un rôle crucial.
- Industrie pharmaceutique : La fabrication d’intermédiaires pharmaceutiques et d’ingrédients pharmaceutiques actifs (API) utilise du chlorure de phosphoryle, facilitant la synthèse de médicaments importants comme les médicaments antipaludiques et anti-inflammatoires.
- Industrie des polymères : Dans la production de polymères, le chlorure de phosphoryle agit comme catalyseur et agent de chloration, contribuant à la synthèse d’additifs ignifuges qui améliorent la résistance au feu des matériaux.
- Fabrication de colorants et de pigments : le chlorure de phosphoryle trouve une application dans la production de colorants et de pigments, en particulier dans la préparation de chloroalkylphosphonates, composés essentiels au développement de colorants utilisés dans les textiles, les encres et les revêtements.
- Réactif de laboratoire : Diverses procédures de laboratoire utilisent le chlorure de phosphoryle comme réactif, notamment la conversion d’alcools en chlorures d’alkyle et la préparation d’agents phosphorylants.
- Traitement de l’eau : les processus de traitement de l’eau utilisent le chlorure de phosphoryle comme agent acidifiant et désinfectant pour contrôler les niveaux de pH et éliminer les impuretés.
- Ignifugeants : le chlorure de phosphoryle joue un rôle dans la production de matériaux ignifuges, améliorant les propriétés de sécurité incendie des textiles, des plastiques et des matériaux de construction.
Ces diverses applications démontrent l’importance du chlorure de phosphoryle dans de nombreux secteurs industriels, soulignant son rôle crucial dans la synthèse chimique, l’agriculture, les produits pharmaceutiques et la science des matériaux.
Des questions
Q : Quelle est la géométrie moléculaire du POCl3 ?
R : La géométrie moléculaire de POCl3 est pyramidale trigonale.
Q : Quel est l’alcène majeur formé lorsque le composé A est déshydraté avec POCl3 et pyridine ?
R : L’alcène majeur formé lors de la déshydratation du composé A avec POCl3 et pyridine dépend de la structure spécifique du composé A.
Q : Le POCl3 est-il polaire ou non polaire
R : POCl3 est une molécule polaire en raison de la présence de liaisons polaires et d’une forme moléculaire asymétrique.
Q : Quel volume de gaz POCl3 peut être produit ?
R : Le volume de gaz POCl3 produit dépend des quantités de réactifs et des conditions de réaction spécifiques.
Q : Combien de moles de POCl3 y a-t-il dans 10,0 grammes de POCl3 ?
R : Il y a environ 0,082 mole de POCl3 dans 10,0 grammes de POCl3.
Q : Quelle est la géométrie des paires d’électrons pour P dans POCl3 ?
R : La géométrie des paires d’électrons pour P dans POCl3 est tétraédrique.
Q : POCl3 a-t-il un moment dipolaire ?
R : Oui, POCl3 a un moment dipolaire en raison de la présence de liaisons polaires et de sa géométrie moléculaire.
Q : POCl3 a-t-il une résonance ?
R : Non, POCl3 ne présente pas de résonance car il n’y a pas d’électrons délocalisés ni de structures de résonance multiples.
Q : Quelle est la géométrie du domaine électronique autour de l’atome d’oxygène dans POCl3 ?
R : La géométrie du domaine électronique autour de l’atome d’oxygène dans POCl3 est pyramidale trigonale.
Q : Quel volume de H3PO4 se formera lorsque 72,3 millilitres de POCl3 réagiront complètement ?
R : Le volume de H3PO4 formé lorsque 72,3 millilitres de POCl3 réagissent complètement dépend de la stœchiométrie de la réaction et ne peut être déterminé uniquement sur la base des informations fournies.
