Zwavelzuur (H2SO4) of vitrioololie is een zeer corrosief en sterk mineraal zuur dat vaak wordt gebruikt in verschillende industriële processen, zoals de productie van kunstmest, aardolieraffinage en metaalverwerking. Het is ook een krachtig dehydraterend middel.
| IUPAC-naam | Zwavelzuur |
| Moleculaire formule | H2SO4 |
| CAS-nummer | 7664-93-9 |
| Synoniemen | Vitrioololie, zwavelzuuranhydride, bizwavelzuur |
| InChi | InChI=1S/H2O4S/c2-1(3)4/h(H2,2,3,4)/p-1 |
Eigenschappen van zwavelzuur
Zwavelzuurformule
De chemische formule voor zwavelzuur is H2SO4, wat staat voor twee waterstofatomen, één zwavelatoom en vier zuurstofatomen. Deze formule vertegenwoordigt de samenstelling van het zwavelzuurmolecuul en de chemische structuur ervan.
Molaire massa van zwavelzuur
De molaire massa van zwavelzuur is 98,08 g/mol. Het wordt berekend door de atoommassa’s van elk element in de chemische formule voor zwavelzuur (H2SO4) op te tellen.
Kookpunt van zwavelzuur
Zwavelzuur heeft een kookpunt van 337,1°C. Bij deze temperatuur bereikt de dampdruk van de vloeistof de atmosferische druk en begint deze te koken.
Smeltpunt van zwavelzuur
Het smeltpunt van zwavelzuur is 10,4°C. Het is bij kamertemperatuur een zeer stroperige vloeistof, maar kan bij lagere temperaturen bevriezen en een vaste toestand vormen.
Dichtheid van zwavelzuur g/ml
De dichtheid van zwavelzuur varieert van 1,84 g/ml tot 1,93 g/ml, afhankelijk van de concentratie. Naarmate de concentratie zwavelzuur toeneemt, neemt ook de dichtheid ervan toe.
Molecuulgewicht van zwavelzuur
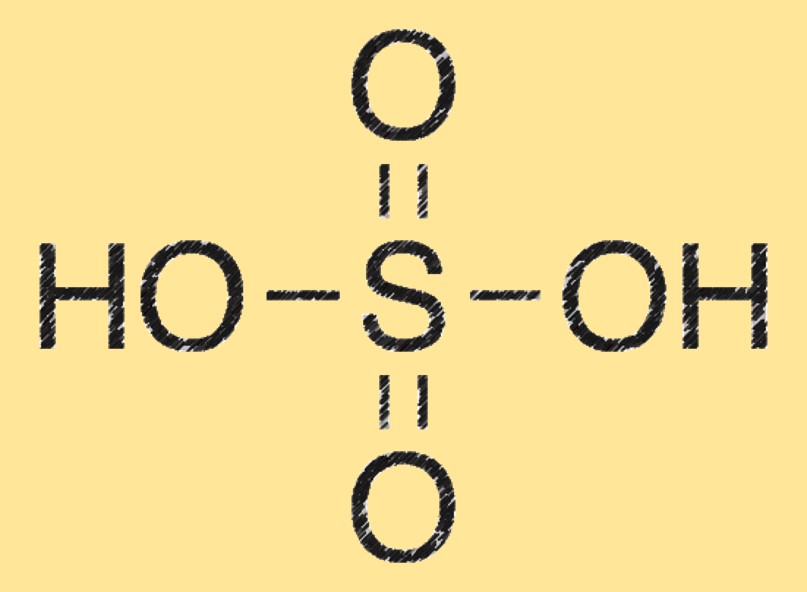
Het molecuulgewicht van zwavelzuur is 98,08 g/mol. Het wordt berekend door de atoommassa’s van elk element in zijn chemische formule (H2SO4) op te tellen.
Structuur van zwavelzuur
Het zwavelzuurmolecuul bestaat uit twee waterstofatomen (H) gebonden aan een zwavelatoom (S) dat ook gebonden is aan vier zuurstofatomen (O). Het heeft een tetraëdrische moleculaire geometrie en is een krachtig dehydraterend middel.
| Verschijning | Heldere, kleurloze, olieachtige vloeistof |
| Soortelijk gewicht | 1,84 (water = 1) |
| Kleur | Kleurloos |
| Geur | Scherpe en zwavelachtige geur |
| Molaire massa | 98,079 g/mol |
| Dikte | 1.835 g/ml |
| Fusie punt | 10,5°C |
| Kookpunt | 337°C |
| Flitspunt | 140°F (60°C) |
| oplosbaarheid in water | Volledig mengbaar |
| Oplosbaarheid | Oplosbaar in water en alcohol |
| Dampdruk | 40 mmHg (20°C) |
| Dampdichtheid | 2,5 (lucht = 1) |
| pKa | -3 |
| pH | Minder dan 1 (sterk zuur) |
Veiligheid en gevaren van zwavelzuur
Zwavelzuur is een zeer bijtende en gevaarlijke stof. Contact met huid en ogen kan ernstige brandwonden en blindheid veroorzaken. Inademing van de dampen kan de luchtwegen irriteren en hoesten, piepende ademhaling en kortademigheid veroorzaken. Het is ontvlambaar en reactief en moet met voorzichtigheid worden gehanteerd in een goed geventileerde ruimte, met behulp van beschermende uitrusting zoals handschoenen en oogbescherming. Gemorste vloeistoffen moeten onmiddellijk worden opgeruimd om schade aan oppervlakken en mogelijk letsel aan mensen te voorkomen. Een goede opslag en etikettering zijn noodzakelijk om een veilige hantering te garanderen.
| Gevarensymbolen | Bijtend, irriterend, schadelijk |
| Beveiligingsbeschrijving | Verwijderd houden van hitte/vonken/open vuur/hete oppervlakken. Niet roken. Opslaan in een goed geventileerde ruimte. Houd de container goed gesloten. Draag beschermende handschoenen/beschermende kleding/oogbescherming/gelaatsbescherming. |
| VN-identificatienummers | VN1830 |
| HS-code | 2815.11.00 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | II |
| Toxiciteit | Oraal: LD50 = 1,2 g/kg (rat) |
Methoden voor de synthese van zwavelzuur
H2SO4 kan op verschillende manieren worden gesynthetiseerd, waaronder het contactproces en het masterkamerproces.
Het contactproces is de meest gebruikte methode voor de industriële productie van zwavelzuur, waarbij zwaveldioxide wordt geoxideerd tot zwaveltrioxide en vervolgens wordt gereageerd met water om H2SO4 te produceren.
Het loodkamerproces daarentegen omvat de oxidatie van zwaveldioxide met stikstofdioxide in aanwezigheid van een katalysator, meestal looddioxide, en het vervolgens laten reageren van het resulterende zwaveltrioxide met water. Beide methoden produceren H2SO4 met verschillende zuiverheids- en concentratieniveaus, dat indien nodig verder kan worden gezuiverd en geconcentreerd.
Gebruik van zwavelzuur
H2SO4 is een veelzijdige chemische stof die veel wordt gebruikt in verschillende industrieën. Mensen gebruiken zwavelzuur vaak bij de productie van meststoffen, wasmiddelen, kleurstoffen en pigmenten. Het speelt ook een rol bij de raffinage van aardolieproducten, de verwerking van mineralen en ertsen, en de productie van chemicaliën zoals salpeterzuur en sulfaten. Laboratoria gebruiken H2SO4 als reagens en dienen als katalysator bij chemische reacties. Loodzuuraccu’s gebruiken zwavelzuur als elektrolyt, en staalproducenten gebruiken het voor het beitsen om roest en aanslag te verwijderen voordat ze worden geplateerd of geverfd.
Over het geheel genomen speelt H2SO4 een cruciale rol in veel industriële processen, waardoor het een van de belangrijkste chemicaliën ter wereld is.
Vragen:
Is zwavelzuur een sterk zuur?
Ja, H2SO4 is een sterk zuur. Een sterk zuur is een zuur dat volledig dissocieert in water en waterstofionen (H+) produceert, wat betekent dat het al zijn waterstofionen aan de oplossing afstaat. Zwavelzuur wordt beschouwd als een van de sterkste zuren en heeft een hoge zuurgraad, waardoor het zeer reactief en corrosief is. Om schade aan mens en milieu te voorkomen is een juiste omgang met en opslag van zwavelzuur essentieel.
Waar wordt zwavelzuur voor gebruikt?
Zwavelzuur wordt veel gebruikt in verschillende industrieën en toepassingen. Enkele van de meest voorkomende toepassingen van H2SO4 zijn:
- Meststofproductie: Zwavelzuur wordt gebruikt bij de productie van fosforzuur, een belangrijk onderdeel van veel meststoffen.
- Olieraffinage: Zwavelzuur wordt gebruikt om tijdens het raffinageproces onzuiverheden zoals zwavelverbindingen uit ruwe olie te verwijderen.
- Metaalverwerking: Zwavelzuur wordt gebruikt bij de metaalverwerking om roest en aanslag van ijzer en staal te verwijderen, en om metaalertsen te verfijnen.
- Productie: Zwavelzuur wordt gebruikt bij de productie van een verscheidenheid aan producten, waaronder wasmiddelen, kleurstoffen, pigmenten en andere chemicaliën.
- Autobatterijen: Zwavelzuur wordt gebruikt als elektrolyt in loodzuurbatterijen, die vaak worden gebruikt in auto’s en andere voertuigen.
- Laboratoriumreagens: Zwavelzuur wordt vaak gebruikt als laboratoriumreagens vanwege de hoge reactiviteit en het vermogen om veel stoffen op te lossen.
Welk type zuur is zwavelzuur?
H2SO4 is een sterk anorganisch zuur. H2SO4, geclassificeerd als diprotisch zuur, doneert twee waterstofionen (H+) aan een oplossing, waardoor het een sterk mineraal zuur wordt. Vanwege de zeer reactieve en corrosieve aard ervan moet voorzichtigheid in acht worden genomen bij het hanteren en opslaan van H2SO4 om schade aan mens en milieu te voorkomen. Industrieën gebruiken zwavelzuur op grote schaal in hun processen, onder meer bij de productie van kunstmest, wasmiddelen, kleurstoffen, pigmenten en andere chemicaliën, maar ook bij de raffinage van aardolieproducten en de verwerking van metaalertsen.
Wat is de formule voor zwavelzuur?
De chemische formule voor zwavelzuur is H2SO4.
Wat is vitrioololie?
Vitrioololie is een andere term voor zwavelzuur, een krachtige en zeer corrosieve chemische stof. Het wordt vaak gebruikt bij de productie van kunstmest, wasmiddelen en kleurstoffen, maar ook bij de raffinage van aardolie en de verwerking van andere chemicaliën.
