Zwaveldichloride (SCl₂) is een chemische verbinding die wordt gevormd door zwavel en chloor te combineren. Het wordt in verschillende industrieën gebruikt om kleurstoffen, rubber en pesticiden te maken.
| IUPAC-naam | Zwaveldichloride |
| Moleculaire formule | SCl₂ |
| CAS-nummer | 10545-99-0 |
| Synoniemen | Chloormonosulfide, zwavelig chloride, zwaveldichloride, zwavelchloride, dichloorsulfaan |
| InChi | InChI=1S/Cl2S/c1-3-2 |
Eigenschappen van zwaveldichloride
Zwaveldichloride-formule
De formule voor zwavelchloride is SCl₂. Het vertegenwoordigt de combinatie van één zwavelatoom en twee chlooratomen. Deze chemische formule weerspiegelt nauwkeurig de samenstelling en structuur van de verbinding.
Zwaveldichloride Molaire massa
De molaire massa van zwavelchloride kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. Zwavel heeft een molaire massa van 32,06 g/mol en chloor heeft een molaire massa van 35,45 g/mol. Door de massa’s van twee chlooratomen en één zwavelatoom op te tellen, wordt de molaire massa van zwavelchloride bepaald op ongeveer 102,91 g/mol.
Kookpunt van zwaveldichloride
Zwavelchloride heeft een kookpunt van 138,8°C (281,8°F). Deze temperatuur geeft het punt aan waarop de vloeibare verbinding onder standaard atmosferische druk in de gasvormige toestand overgaat. Het is belangrijk om rekening te houden met het kookpunt van zwavelchloride wanneer u ermee werkt of het in verschillende toepassingen gebruikt.
Zwaveldichloride Smeltpunt
Het smeltpunt van zwavelchloride is -76,8°C (-106,2°F). Deze temperatuur vertegenwoordigt het punt waarop de vaste verbinding overgaat in de vloeibare toestand. Het kennen van het smeltpunt is essentieel bij het werken met zwavelchloride om een juiste hantering en opslag te garanderen.
Dichtheid van zwaveldichloride g/ml
Zwavelchloride heeft een dichtheid van ongeveer 1,64 g/ml. De dichtheidswaarde geeft de hoeveelheid massa per volume-eenheid van de stof aan. Deze eigenschap is essentieel voor het begrijpen van het gedrag en de kenmerken van zwavelchloride in verschillende contexten, zoals tijdens chemische reacties of voor het bepalen van de geschiktheid ervan voor specifieke toepassingen.
Zwaveldichloride Molecuulgewicht
Het molecuulgewicht van zwavelchloride is ongeveer 102,91 g/mol. Het vertegenwoordigt de totale massa van een molecuul van de verbinding, berekend door de atoommassa’s van de samenstellende elementen op te tellen. Het molecuulgewicht levert waardevolle informatie op over de massa van de verbinding en maakt nauwkeurige metingen bij verschillende chemische berekeningen mogelijk.
Structuur van zwaveldichloride
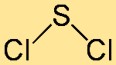
De structuur van zwavelchloride kan het beste worden omschreven als een gebogen of V-vormig molecuul. Het bestaat uit een centraal zwavelatoom gebonden aan twee chlooratomen. De rangschikking van atomen en hun bindingshoeken dragen bij aan de algehele stabiliteit en reactiviteit van de verbinding.
Oplosbaarheid van zwaveldichloride
Zwavelchloride heeft een beperkte oplosbaarheid in water. Het is slecht oplosbaar en heeft de neiging een troebele oplossing te vormen wanneer het met water wordt gemengd. De oplosbaarheidskenmerken van de verbinding zijn belangrijk om in overweging te nemen bij het bepalen van de verenigbaarheid ervan met andere stoffen en het gedrag ervan in verschillende oplosmiddelen.
| Verschijning | Gele vloeistof |
| Soortelijk gewicht | 1,64 g/ml |
| Kleur | GEEL |
| Geur | Akko |
| Molaire massa | 102,91 g/mol |
| Dikte | 1,64 g/ml |
| Fusie punt | -76,8°C |
| Kookpunt | 138,8°C |
| Flitspunt | Niet beschikbaar |
| oplosbaarheid in water | Reageert |
| Oplosbaarheid | Oplosbaar in ijsazijn, benzeen, broom |
| Dampdruk | 35,4 mmHg |
| Dampdichtheid | 3,9 (lucht=1) |
| pKa | Niet beschikbaar |
| pH | Niet beschikbaar |
Veiligheid en gevaren van zwaveldichloride
Zwavelchloride brengt verschillende veiligheidsrisico’s met zich mee en moet met voorzichtigheid worden gehanteerd. Het is zeer bijtend en kan ernstige brandwonden veroorzaken bij contact met de huid, ogen of slijmvliezen. Inademing van de dampen kan de luchtwegen irriteren en hoesten, ademhalingsmoeilijkheden en longschade veroorzaken. Het is ook brandbaar en kan ontbranden in de aanwezigheid van bepaalde stoffen. Bij het werken met zwavelchloride moeten geschikte beschermende uitrusting zoals handschoenen, een veiligheidsbril en ademhalingsbescherming worden gebruikt. Het is essentieel om deze verbinding te hanteren en op te slaan in een goed geventileerde ruimte, uit de buurt van ontstekingsbronnen en incompatibele materialen, om ongelukken en mogelijke schade te voorkomen.
| Gevarensymbolen | Bijtend |
| Beveiligingsbeschrijving | Vermijd contact, draag beschermende uitrusting, werk in goed geventileerde ruimtes |
| VN-identificatienummers | Een 1828 |
| HS-code | 2812.10.00 |
| Gevarenklasse | 8 (Bijtende stoffen) |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig |
Methoden voor de synthese van zwaveldichloride
Er zijn verschillende methoden voor het synthetiseren van zwavelchloride. Een gebruikelijke aanpak betreft de reactie tussen zwavel- en chloorgas. Bij dit proces is er een overmaat aan chloor aanwezig bij het verwarmen van de zwavel tot een specifieke temperatuur, gewoonlijk rond de 200-250°C (392-482°F). De reactie verloopt onder vorming van zwavelchloride.
Een andere methode is de reactie tussen thionylchloride (SOCl₂) en zwavel. Thionylchloride fungeert als een bron van chloor, dat reageert met zwavel om zwavelchloride te produceren. Deze reactie vindt plaats bij een relatief lagere temperatuur dan de directe zwavel-chloormethode.
De reactie tussen zwavelchloride (SO₂Cl₂) en waterstofsulfide (H₂S) maakt de bereiding van zwavelchloride mogelijk. Deze reactie vindt plaats bij hoge temperaturen en produceert zwavelchloride en andere bijproducten.
Om de veiligheid van het betrokken personeel te garanderen, is het van cruciaal belang om de synthese van zwavelchloride uit te voeren in goed uitgeruste laboratoria of industriële omgevingen. Vanwege de gevaarlijke aard van de verbinding moet het personeel passende veiligheidsmaatregelen nemen, waaronder het dragen van beschermende uitrusting en het werken in goed geventileerde ruimtes.
De keuze voor de synthesemethode hangt af van verschillende factoren, waaronder de beschikbaarheid van grondstoffen, de gewenste zuiverheid van het product en specifieke toepassingseisen. Het selecteren van de juiste techniek hangt af van de specifieke behoeften van het proces of de toepassing, omdat elke methode zijn eigen voordelen en overwegingen heeft.
Gebruik van zwaveldichloride
Zwavelchloride (SCl₂) vindt vanwege zijn specifieke eigenschappen toepassingen in verschillende industrieën en processen. Hier zijn enkele belangrijke toepassingen van zwavelchloride:
- Kleurstofproductie: Fabrikanten gebruiken zwavelchloride om kleurstoffen te produceren, met name zwavelkleurstoffen, die levendige kleuren geven aan stoffen in de textielindustrie.
- Rubberindustrie: De rubberindustrie gebruikt SCl₂ als vulkanisatiemiddel om de sterkte en elasticiteit van rubberproducten te verbeteren door polymeerketens te verknopen.
- Synthese van pesticiden: Zwavelchloride speelt een cruciale rol bij de synthese van bepaalde pesticiden, waardoor de productie mogelijk wordt van insecticiden en fungiciden die organofosfaatverbindingen en organothiofosfaten worden genoemd.
- Chemische synthese: SCl₂ dient als veelzijdig reagens bij verschillende chemische reacties, waardoor chloreringsreacties mogelijk zijn, zoals de omzetting van alcoholen in alkylchloriden of de synthese van gechloreerde organische verbindingen.
- Laboratoriumreagens: Laboratoria gebruiken zwavelchloride als reagens voor meerdere toepassingen, waaronder organische synthese, zwavelchemie en anorganische reacties.
- Waterbehandeling: Waterbehandelingsprocessen gebruiken SCl₂ als desinfectie- en oxidatiemiddel om schadelijke micro-organismen en organische verontreinigende stoffen uit waterbronnen te verwijderen.
- Farmaceutische industrie: Zwavelchloride vindt toepassingen in farmaceutisch onderzoek en ontwikkeling, met name in de synthese van bepaalde actieve farmaceutische ingrediënten (API).
- Chemische analyse: Analytische chemische technieken, zoals gaschromatografie, gebruiken SCl₂ om specifieke verbindingen te detecteren en analyseren.
Deze verschillende toepassingen benadrukken het belang van zwavelchloride in verschillende industriële processen en wetenschappelijke inspanningen. Het is echter belangrijk om zwavelchloride zorgvuldig te hanteren en te gebruiken, en de juiste veiligheidsrichtlijnen en -procedures te volgen vanwege de gevaarlijke aard ervan.
Vragen:
Vraag: Wat is de formule voor zwaveldichloride?
A: De formule voor zwavelchloride is SCl₂.
Vraag: Welke formule vertegenwoordigt de moleculaire verbinding zwaveldichloride?
A: De moleculaire verbinding zwavelchloride wordt weergegeven door de formule SCl2.
Vraag: Is zwaveldichloride polair?
A: Ja, zwavelchloride is polair vanwege de aanwezigheid van een gebogen moleculaire geometrie en een ongelijkmatige verdeling van de elektronendichtheid.
Vraag: Welke atomaire of hybride orbitalen vormen de sigmabinding tussen S en Cl in zwaveldichloride, SCl₂?
A: De sigmabinding tussen zwavel (S) en chloor (Cl) in zwavelchloride (SCl₂) wordt gevormd door de overlap van de 3p-orbitaal van zwavel en de 3p-orbitaal van chloor.
Vraag: Is SCl₂ lineair?
A: Nee, zwavelchloride (SCl₂) is niet lineair. Het heeft een gebogen of V-vormige moleculaire geometrie.
Vraag: Welke van de volgende is een ionische verbinding? Cl₂O, CH₂O, SCl₂, PF₅, Mg₃(PO₄)₂.
A: Geen van de genoemde verbindingen zijn ionische verbindingen. Dit zijn ofwel moleculaire verbindingen (Cl₂O, CH₂O, SCl₂, PF₅) ofwel een anorganische fosfaatverbinding (Mg₃(PO₄)₂).
Vraag: Wat is de naam van de verbinding met de formule SCl₂?
A: De verbinding met de formule SCl₂ wordt zwavelchloride genoemd.
Vraag: Wat is de vorm van SCl₂?
A: SCl₂ heeft een gebogen of V-vormige moleculaire vorm.
Vraag: Wat is de moleculaire geometrie van SCl₂?
A: De moleculaire geometrie van SCl₂ is gebogen of V-vormig.
Vraag: Wat zijn de namen van de hybride orbitalen die door zwavel in SCl₂ worden gebruikt?
A: Het zwavelatoom in SCl₂ maakt gebruik van sp² hybride orbitalen.
Vraag: Wat gebeurt er als één zwavelatoom zich combineert met twee chlooratomen om SCl₂ te produceren?
A: Wanneer één zwavelatoom zich combineert met twee chlooratomen, vormt het de verbinding SCl₂, bekend als zwavelchloride. Het zwavelatoom deelt elektronen met de chlooratomen om een covalente binding daartussen te creëren.
