Zinksulfide (ZnS) is een verbinding bestaande uit zink en zwavel. Het wordt gebruikt in verschillende toepassingen, waaronder lichtgevende materialen, opto-elektronica en fosforen voor LED-displays.
| IUPAC-naam | Zinksulfide |
| Moleculaire formule | ZnS |
| CAS-nummer | 1314-98-3 |
| Synoniemen | Sphaleriet, Blende, Zink Blende, Wurtziet |
| InChi | InChI=1S/S.Zn |
Eigenschappen van zinksulfide
Zinksulfide-formule
De chemische formule voor zinksulfide is ZnS, wat de samenstelling van zink- (Zn) en zwavel- (S) atomen aangeeft. Deze verbinding vormt vanwege zijn unieke eigenschappen een cruciaal onderdeel van verschillende industriële en wetenschappelijke toepassingen.
Zinksulfide Molaire Massa
Zinksulfide heeft een molaire massa van ongeveer 97,45 gram per mol. Deze waarde vertegenwoordigt de gecombineerde atoommassa’s van de samenstellende zink- en zwavelatomen in een enkel ZnS-molecuul.
Kookpunt van zinksulfide
Zinksulfide heeft geen duidelijk kookpunt omdat het de neiging heeft te ontleden in plaats van een echt kookproces te ondergaan bij verhitting. Dit kenmerk is het gevolg van de chemische eigenschappen ervan.
Smeltpunt van zinksulfide
Zinksulfide heeft een smeltpunt van ongeveer 1.850 graden Celsius (3.362 graden Fahrenheit). Dit hoge smeltpunt maakt het geschikt voor diverse toepassingen bij hoge temperaturen.
Dichtheid van zinksulfide g/ml
De dichtheid van zinksulfide varieert afhankelijk van de kristalvorm. Over het algemeen ligt de dichtheid tussen 3,98 en 4,09 gram per kubieke centimeter (g/cm³). Dit dichtheidsbereik draagt bij aan het gebruik ervan in optische materialen.
Zinksulfide Molecuulgewicht
Het molecuulgewicht van zinksulfide, berekend door de atoommassa’s van de componenten op te tellen, bedraagt ongeveer 97,45 gram per mol. Deze waarde is cruciaal voor het bepalen van de hoeveelheid ZnS in een bepaald monster.
Structuur van zinksulfide
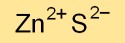
Zinksulfide bestaat in verschillende kristalstructuren, voornamelijk als kubisch zinkblende (ook bekend als sphaleriet) en hexagonaal wurtziet. Deze rangschikkingen van atomen bepalen de fysieke en optische eigenschappen ervan.
Oplosbaarheid van zinksulfide
Zinksulfide is slecht oplosbaar in water, waardoor het vrijwel onoplosbaar is. Dit kenmerk is te danken aan de sterke bindingen tussen zink- en zwavelatomen, wat resulteert in een beperkte oplossing in waterige oplossingen. Het kan echter onder specifieke omstandigheden worden opgelost in bepaalde zuren of alkaliën.
| Verschijning | Stevig |
| Soortelijk gewicht | 3,98 – 4,09 g/cm³ |
| Kleur | Wit, geel, bruin, zwart |
| Geur | Geurloos |
| Molaire massa | ~97,45 g/mol |
| Dikte | 3,98 – 4,09 g/cm³ |
| Fusie punt | ~1850°C (~3362°F) |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Vrijwel onoplosbaar |
| Oplosbaarheid | Oplosbaar in zuren, alkaliën onder specifieke omstandigheden |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | ~4,7 |
| pH | ~7 (neutraal) |
Veiligheid en gevaren van zinksulfide
Zinksulfide heeft een lage acute toxiciteit, maar kan bij verhitting giftig zwaveldioxide afgeven. Het wordt over het algemeen als veilig beschouwd onder normale gebruiksomstandigheden. Het inademen van stof of dampen kan echter irritatie van de luchtwegen veroorzaken. Vermijd contact met huid en ogen. In geval van blootstelling, grondig afspoelen en een arts raadplegen als de irritatie aanhoudt. Brand of overmatige hitte kunnen ontleding veroorzaken en gevaarlijke gassen vrijgeven. Uit de buurt van onverenigbare materialen bewaren. Ga er voorzichtig mee om, draag geschikte beschermende uitrusting en werk in goed geventileerde ruimtes om de veiligheid te garanderen en potentiële gevaren in verband met zinksulfide te voorkomen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Lage acute toxiciteit; geeft bij verhitting giftig zwaveldioxidegas af; breekbaar |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 2830.90.10 |
| Gevarenklasse | Niet geclassificeerd als gevaarlijk |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit; irritatie van de luchtwegen door stof of dampen; breekbaar |
Methoden voor de synthese van zinksulfide
Zinksulfide kan op verschillende manieren worden gesynthetiseerd. Een gebruikelijke aanpak is om zinkoxide (ZnO) en waterstofsulfide (H2S) gassen bij verhoogde temperaturen te laten reageren. De reactie verloopt als volgt:
ZnO (s) + H2S (g) → ZnS (s) + H2O (g)
Een andere methode omvat de reactie tussen zinkchloride (ZnCl2) en waterstofsulfidegas:
ZnCl2 (aq) + H2S (g) → ZnS (s) + 2 HCl (g)
Als alternatief kunnen zinksulfide-nanodeeltjes worden gesynthetiseerd met behulp van precipitatiemethoden. Hierbij worden oplosbare zinkzouten onder gecontroleerde omstandigheden gemengd met oplosbare sulfidezouten, wat leidt tot de vorming van zinksulfide-nanodeeltjes. In sommige gevallen worden organische verbindingen gebruikt als afsluitingsmiddelen om de deeltjesgrootte en stabiliteit te controleren.
Zinksulfide kan ook worden bereid door metallisch zink te laten reageren met elementaire zwavel. De twee stoffen worden samen verwarmd om de reactie op gang te brengen:
Zn(s) + S(s) → ZnS(s)
Deze methoden bieden veelzijdigheid bij het produceren van zinksulfide met verschillende eigenschappen voor verschillende toepassingen, zoals opto-elektronica, luminescerende materialen, enz.
Gebruik van zinksulfide
Zinksulfide vindt vanwege zijn unieke eigenschappen verschillende toepassingen in verschillende industrieën. Hier zijn de opmerkelijke toepassingen:
- Optische coatings: De transparantie van zinksulfide in het infraroodgebied maakt het een waardevol materiaal voor optische coatings, lenzen en vensters in warmtebeeldsystemen en sensoren.
- Lichtgevende materialen: Het dient als gastheermateriaal om luminescerende verbindingen te creëren, zoals kopergedoteerd zinksulfide voor glow-in-the-dark-toepassingen.
- Halfgeleidertoepassingen: In dunnefilmtransistors en andere halfgeleiderapparaten spelen zinksulfidefilms een rol in elektronische componenten.
- LED-displayfosforen: LED-displays gebruiken zinksulfidefosforen om de kleur en helderheid te verbeteren.
- Röntgen- en gammastralingsdetectie: Scintillatiedetectoren gebruiken de sprankelende eigenschappen van zinksulfide om röntgen- en gammastraling te detecteren.
- Pigmenten en verven: Witte pigmenten in verven, coatings en drukinkten gebruiken specifieke vormen van zinksulfide, zoals zinkwit of lithopoon.
- Fluorescerende markers: In biologische toepassingen functionaliteitiseren onderzoekers zinksulfide-nanodeeltjes voor fluorescerende markers in beeldvormingsstudies.
- Zonnecellen: Wetenschappers bestuderen zinksulfide-nanodeeltjes om hun potentieel te bepalen om de lichtabsorptie in fotovoltaïsche zonnecellen te verbeteren.
- Katalyse: Onderzoekers onderzoeken de aard van de halfgeleiders en bestuderen de katalytische eigenschappen van zinksulfide in verschillende chemische reacties.
- Infraroodvensters: Optische apparaten zoals camera’s, telescopen en sensoren waarin zinksulfide is verwerkt voor infraroodvensters.
De veelzijdigheid van zinksulfide komt voort uit zijn vermogen om luminescentie, transparantie en halfgeleidergedrag te vertonen. De op maat gemaakte toepassingen dragen aanzienlijk bij aan gebieden als optica, elektronica, energie en materiaalkunde.
Vragen:
Vraag: Wat is de formule voor zinksulfide?
A: De formule voor zinksulfide is ZnS.
Vraag: Is zinksulfide oplosbaar?
A: Zinksulfide is over het algemeen onoplosbaar in water.
Vraag: Is ZnS oplosbaar in water?
A: Nee, ZnS is niet oplosbaar in water.
Vraag: Zinksulfide bevat 67,1 massaprocent zink. Wat is de massafractie van zwavel in zinksulfide?
A: De massafractie van zwavel in zinksulfide is 32,9%.
Vraag: Hoe kun je zinkchloride scheiden van zinksulfide?
A: Zinkchloride en zinksulfide kunnen worden gescheiden door het zinkchloride in water op te lossen, waarbij het onoplosbare zinksulfide achterblijft.
Vraag: Is zinksulfide ionisch?
A: Ja, zinksulfide is voornamelijk ionisch.
Vraag: Welk type stoichiometrisch defect wordt vertegenwoordigd door ZnS?
A: Zinksulfide kan stoichiometrische defecten van het Frenkel-type vertonen.
Vraag: Wat is ZnS?
A: ZnS is de chemische formule voor zinksulfide, een verbinding van zink en zwavel.
Vraag: Wat is de minimale pH die nodig is om ZnS-precipitatie te voorkomen?
A: De minimale pH die nodig is om ZnS-precipitatie te voorkomen is ongeveer 4,7.
Vraag: Deze afbeelding toont de kubieke eenheidscel voor ZnS. Hoeveel Zn²⁺-ionen zijn er in deze kubieke cel?
A: In de kubieke cel van ZnS zijn er vier Zn²⁺-ionen.
Vraag: Is ZnS ionisch of covalent?
A: ZnS wordt voornamelijk als ionisch beschouwd.
Vraag: Welk type reactie is Zn + S = ZnS?
A: De reactie Zn + S = ZnS is een synthese- of combinatiereactie.
