Zinksulfaat is een verbinding met de chemische formule ZnSO4. Het wordt vaak gebruikt als voedingssupplement om zinktekort te behandelen en als meststof voor gewassen.
| IUPAC-naam | Zinksulfaat |
| Moleculaire formule | ZnSO4 |
| CAS-nummer | 7733-02-0 |
| Synoniemen | Witte vitriol, Zinkvitriol, Zink(II)sulfaat, Zink(2+)sulfaat, Zinkmonosulfaat, Zinksulfaatheptahydraat, Zinksulfaatmonohydraat |
| InChi | InChI=1S/2O.H2S.Zn/h2*1H;1H2;/q;;;+2/p-2 |
Zinksulfaatformule
De chemische formule voor zinksulfaat is ZnSO4. Het bestaat uit een zinkion (Zn2+) en een sulfaation (SO42-). De formule laat zien dat zinksulfaat één zinkatoom, één zwavelatoom en vier zuurstofatomen bevat.
Molaire massa van zinksulfaat
De molaire massa van zinksulfaat (ZnSO4) is 161,44 g/mol. Het is de som van de atoommassa’s van alle atomen die aanwezig zijn in één mol van de verbinding. Zinksulfaat bestaat uit één zinkatoom (Zn), één zwavelatoom (S) en vier zuurstofatomen (O). Molaire massa is een essentiële parameter die wordt gebruikt bij stoichiometrische berekeningen om de hoeveelheid reactanten en producten in een chemische reactie te bepalen.
Kookpunt van zinksulfaat
Zinksulfaat heeft geen gedefinieerd kookpunt omdat het ontleedt voordat het zijn kookpunt bereikt. De verbinding ondergaat thermische ontleding bij ongeveer 680°C, waarbij zinkoxide (ZnO), zwaveldioxide (SO2) en zuurstof (O2) gassen worden gevormd. De ontledingstemperatuur wordt beïnvloed door de aanwezigheid van onzuiverheden, druk en verwarmingssnelheid. Zinksulfaat is stabiel bij lage temperaturen en is oplosbaar in water, methanol en ethanol.
Smeltpunt van zinksulfaat
Het smeltpunt van zinksulfaat hangt af van het hydratatieniveau van de verbinding. Zinksulfaat-heptahydraat (ZnSO4.7H2O) heeft een smeltpunt van 100°C, terwijl zinksulfaat-monohydraat (ZnSO4.H2O) smelt bij 70°C. Watervrij zinksulfaat (ZnSO4) ontleedt voordat het smelt. Het smeltpunt wordt beïnvloed door factoren zoals druk, zuiverheid en verwarmingssnelheid.
Dichtheid van zinksulfaat g/ml
De dichtheid van zinksulfaat varieert afhankelijk van de hydratatietoestand. Zinksulfaatheptahydraat heeft een dichtheid van 1,957 g/cm³, zinksulfaatmonohydraat heeft een dichtheid van 3,08 g/cm³ en watervrij zinksulfaat heeft een dichtheid van 3,54 g/cm³. Dichtheid is een fysieke eigenschap die de hoeveelheid massa per volume-eenheid van een stof bepaalt. De dichtheid van zinksulfaat wordt ook beïnvloed door temperatuur en druk.
Molecuulgewicht van zinksulfaat
Het molecuulgewicht van zinksulfaat is 161,44 g/mol. Het wordt berekend door de atoomgewichten van zink, zwavel en zuurstof op te tellen, die respectievelijk 65,38 g/mol, 32,06 g/mol en 63,998 g/mol zijn. Het molecuulgewicht wordt gebruikt bij verschillende berekeningen, zoals het bepalen van de concentratie van zinksulfaatoplossingen in scheikundige en biologische experimenten.
Structuur van zinksulfaat
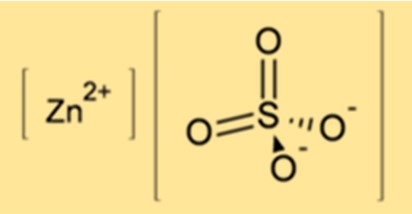
Zinksulfaat heeft in zijn watervrije vorm een kristallijne structuur, waarbij zinkkationen (Zn2+) en sulfaatanionen (SO42-) afwisselend zijn gerangschikt. Het zinkkation wordt gecoördineerd door zes zuurstofatomen uit zes sulfaatanionen, waardoor een vervormde octaëdrische geometrie ontstaat. In gehydrateerde vorm vormt zinksulfaatheptahydraat monokliene kristallen, terwijl zinksulfaatmonohydraat orthorhombische kristallen vormt. De watermoleculen in de hydraten zijn door waterstofbinding zwak verbonden met het zinksulfaatnetwerk.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 3,54 g/cm³ (watervrij) |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 161,44 g/mol |
| Dikte | 1,957 g/cm³ (heptahydraat), 3,08 g/cm³ (monohydraat), 3,54 g/cm³ (watervrij) |
| Fusie punt | 70°C (monohydraat), 100°C (heptahydraat) |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water, methanol en ethanol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | pKa1=1,9, pKa2=3,1, pKa3=9,8 |
| pH | De pH van de 0,1 M oplossing is 4,2 |
Veiligheid en gevaren van zinksulfaat
Zinksulfaat is over het algemeen veilig in gebruik als het volgens de aanwijzingen wordt gebruikt. Bij contact kan het echter irritatie aan de ogen, de huid en de luchtwegen veroorzaken. Inslikken van grote hoeveelheden kan misselijkheid, braken en diarree veroorzaken. Langdurige blootstelling aan zinksulfaatstof kan irritatie van de luchtwegen of metaaldampkoorts veroorzaken. Het is belangrijk om geschikte persoonlijke beschermingsmiddelen (PBM’s), zoals handschoenen en een veiligheidsbril, te dragen bij het hanteren van zinksulfaat. In geval van accidentele blootstelling de getroffen gebieden met veel water afspoelen en indien nodig een arts raadplegen. Bewaar zinksulfaat in een goed gesloten container en uit de buurt van onverenigbare stoffen.
| Gevarensymbolen | XI |
| Beveiligingsbeschrijving | Buiten bereik van kinderen houden. Draag beschermende handschoenen/beschermende kleding/oogbescherming/gelaatsbescherming. BIJ CONTACT MET DE OGEN: voorzichtig afspoelen met water gedurende enkele minuten. Verwijder contactlenzen, indien aanwezig en gemakkelijk te doen. Ga door met spoelen. NA INSLIKKEN: Mond spoelen. GEEN braken opwekken. Zoek medisch advies/zorg als u zich onwel voelt. Inhoud/verpakking afvoeren in overeenstemming met lokale/regionale/nationale/internationale regelgeving. |
| AN-identificaties | Niet gereguleerd |
| HS-code | 2833.29.90 |
| Gevarenklasse | 9 – Diverse gevaarlijke goederen |
| Verpakkingsgroep | III |
| Toxiciteit | Van zinksulfaat wordt algemeen aangenomen dat het een lage toxiciteit heeft. Inname van grote hoeveelheden kan echter maag-darmirritatie veroorzaken en leiden tot braken, diarree en uitdroging. Inademing van stof of nevel kan de luchtwegen irriteren. Zinksulfaat kan bij contact oog- en huidirritatie veroorzaken. Langdurige blootstelling aan hoge concentraties zinksulfaatstof kan leiden tot metaaldampkoorts. |
Zinksulfaatsynthesemethoden
Er zijn verschillende methoden voor het synthetiseren van zinksulfaat, afhankelijk van de gewenste zuiverheid, deeltjesgrootte en hydratatieniveau van het eindproduct. Een gebruikelijke methode omvat de reactie van metallisch zink of zinkoxide met zwavelzuur:
1. Zinkmetaal + zwavelzuur → zinksulfaat + waterstofgas
2. Zinkoxide + zwavelzuur → Zinksulfaat + water
Om de opbrengst en zuiverheid van zinksulfaat te optimaliseren, moet de reactie worden uitgevoerd onder gecontroleerde omstandigheden van temperatuur, roeren en zuurconcentratie. Pas daarna verdere verwerkingsstappen toe zoals kristallisatie, drogen en zeven op de resulterende zinksulfaatoplossing om de gewenste deeltjesgrootte en hydratatieniveau te bereiken.
Een andere methode om zinksulfaat te produceren omvat de reactie van zinkerts of concentraat met zwavelzuur:
3. Zinkerts/concentraat + zwavelzuur → zinksulfaat + ijzersulfaat + water
Zinksulfaat kan worden gescheiden van ijzersulfaat en andere onzuiverheden met behulp van technieken zoals filtratie, precipitatie of oplosmiddelextractie.
Om zinksulfaat te produceren, kan zinkcarbonaat of zinkhydroxide worden gereageerd met zwavelzuur, of zinkas kan worden geoxideerd met zwavelzuur.
De keuze voor de methode is afhankelijk van factoren als beschikbaarheid van grondstoffen, kosten en productspecificaties.
Gebruik van zinksulfaat
Zinksulfaat heeft vanwege zijn unieke eigenschappen een breed scala aan industriële, agrarische en medische toepassingen. Hier zijn enkele veelvoorkomende toepassingen van zinksulfaat:
- Meststof: Gebruikt als meststof met micronutriënten die essentieel zink aan planten levert voor een gezonde groei en ontwikkeling.
- Dierenvoer: toegevoegd aan diervoer als voedingssupplement om zinktekort te voorkomen en de algehele gezondheid te verbeteren.
- Waterbehandeling: Gebruikt in waterzuiveringsinstallaties om onzuiverheden te verwijderen en troebelheid te verminderen.
- Galvaniseren: Wordt gebruikt bij het galvaniseren, waarbij ijzer en staal worden voorzien van een laagje zink om corrosie te voorkomen.
- Geneeskunde: Medicinaal gebruikt als voedingssupplement om zinktekort te behandelen, maar ook in plaatselijke zalven om huidaandoeningen zoals eczeem en acne te behandelen.
- Verven: Gebruikt bij het verven en bedrukken van textiel om de kleurechtheid en helderheid van kleurstoffen te verbeteren.
- Galvaniseren: Gebruikt bij galvaniseren om een laag zink op metalen oppervlakken aan te brengen voor corrosiebescherming en decoratieve doeleinden.
- Vlamvertrager: Gebruikt als vlamvertrager in kunststoffen, rubber en andere materialen om het risico op brand te verminderen.
- Andere toepassingen: Gebruikt bij de productie van pigmenten, papier, zepen en wasmiddelen.
Vragen:
Vraag: Wat zou je waarnemen als zink wordt toegevoegd aan een ijzersulfaatoplossing?
A: Wanneer zink wordt toegevoegd aan een oplossing van ijzersulfaat, vindt er een verdringingsreactie plaats. Het meer reactieve zink verdringt het minder reactieve ijzer uit de sulfaatoplossing, waardoor zinksulfaat en metallisch ijzer worden gevormd. De reactie kan worden waargenomen als de vorming van een roodbruine vaste stof en het vrijkomen van waterstofgas.
Vraag: Wat gebeurt er als een stukje zink wordt toegevoegd aan een oplossing van kopersulfaat?
A: Wanneer een stuk metallisch zink wordt toegevoegd aan een oplossing van kopersulfaat, vindt er een verdringingsreactie plaats. Zink is reactiever dan koper, dus verdringt het koper uit de sulfaatoplossing en vormt zinksulfaat en een roodbruine vaste stof van metallisch koper. De reactie kan worden waargenomen wanneer de oplossing blauw wordt, omdat er koperionen in de oplossing vrijkomen en er een vaste koperafzetting op het oppervlak van het zinkmetaal ontstaat.
Vraag: Is zinksulfaat een zout?
A: Ja, zinksulfaat is een zout dat bestaat uit zinkionen (Zn2+) en sulfaationen (SO42-). Het is een witte kristallijne verbinding met de formule ZnSO4 en wordt veel gebruikt in verschillende toepassingen zoals meststoffen, veevoer en medicijnen.
Vraag: Waar kan ik zinksulfaatpoeder kopen?
A: Zinksulfaatpoeder kan worden gekocht bij chemische leveranciers, online retailers en winkels voor landbouwbenodigdheden. Het is belangrijk om ervoor te zorgen dat het product van hoge kwaliteit is en geschikt is voor het beoogde gebruik.
Vraag: Is zinksulfaat oplosbaar?
A: Ja, zinksulfaat is oplosbaar in water en glycerol. De oplosbaarheid van zinksulfaat varieert met de temperatuur, met een hogere oplosbaarheid bij hogere temperaturen. De oplosbaarheid kan ook worden beïnvloed door de aanwezigheid van andere ionen in de oplossing.
Vraag: Waar wordt zinksulfaat voor gebruikt?
A: Zinksulfaat heeft verschillende toepassingen, waaronder het gebruik ervan als meststof, diervoedersupplement, waterbehandelingsmiddel, medicijn en bij de productie van pigmenten, papier en textiel. Het wordt ook gebruikt bij het galvaniseren, in vlamvertragers en als voedingssupplement om zinktekort te behandelen en de algehele gezondheid te ondersteunen.
