Zinkcitraat (C12H10O14Zn3) is een verbinding met drie zinkionen gebonden aan citraatmoleculen. Het wordt vaak gebruikt in supplementen vanwege de potentiële gezondheidsvoordelen, zoals het ondersteunen van de immuniteit en de spijsvertering.
| IUPAC-naam | Trizinkdicitraat |
| Moleculaire formule | C12H10O14Zn3 |
| CAS-nummer | 546-46-3 |
| Synoniemen | Citroenzuur, zinkzout; Trizinkcitraat; Zinktricitraat; Trizinkzout van citroenzuur |
| InChi | InChI=1S/2C6H8O7,3Zn/c2 7-3(8)1-6(13,5(11)12)2-4(9)10;;;/h2 13H,1-2H2,(H,7, 8) (H,9,10)(H,11,12);;;/q;;3*+2/p-6 |
Eigenschappen van zinkcitraat
Zinkcitraatformule
De chemische formule van trizinkcitraat is C12H10O14Zn3. Dit betekent de rangschikking van 12 koolstofatomen, 10 waterstofatomen, 14 zuurstofatomen en 3 zinkatomen in de verbinding.
Zinkcitraat molaire massa
De molaire massa van trizinkcitraat wordt berekend door de atoommassa’s van de samenstellende elementen bij elkaar op te tellen. Het weegt ongeveer 574,38 g/mol.
Kookpunt van zinkcitraat
Het kookpunt van trizinkcitraat verwijst naar de temperatuur waarbij het overgaat van een vloeistof naar een gas. Trizinkcitraat ontleedt echter doorgaans voordat het een duidelijk kookpunt bereikt vanwege de complexe aard ervan.
Zinkcitraat smeltpunt
Het smeltpunt van trizinkcitraat, de temperatuur waarbij het overgaat van vast naar vloeibaar, ligt doorgaans tussen 190°C en 200°C. Dit temperatuurbereik kan enigszins variëren, afhankelijk van factoren zoals onzuiverheden en kristalstructuur.
Dichtheid van zinkcitraat g/ml
De dichtheid van trizinkcitraat, die de massa per volume-eenheid meet, is ongeveer 1,98 g/ml. Deze dichtheid geeft aan dat trizinkcitraat relatief compact en compact is.
Zinkcitraat Moleculair gewicht
Het molecuulgewicht van trizinkcitraat wordt bepaald door de atoomgewichten van de samenstellende elementen op te tellen. Met een molecuulformule van C12H10O14Zn3 heeft het een molecuulgewicht van ongeveer 574,38 g/mol.
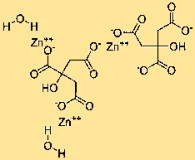
Structuur van zinkcitraat
Trizinkcitraat heeft een complexe structuur waarbij drie zinkionen worden gecoördineerd met citraatmoleculen. Deze opstelling vormt een driedimensionaal netwerk dat bij elkaar wordt gehouden door chemische bindingen. De precieze rangschikking van atomen binnen de structuur draagt bij aan de eigenschappen en het gedrag ervan.
Oplosbaarheid van zinkcitraat
De oplosbaarheid van trizinkcitraat, die het vermogen om op te lossen in een oplosmiddel zoals water definieert, wordt beïnvloed door verschillende factoren, waaronder temperatuur en pH. Over het algemeen is trizinkcitraat oplosbaar in water en de oplosbaarheid ervan neemt toe bij een hogere zuurgraad.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 1,98 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 574,38 g/mol |
| Dikte | 1,98 g/ml |
| Fusie punt | 190°C – 200°C |
| Kookpunt | Ontleedt voordat een bepaald kookpunt wordt bereikt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in water |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Het hangt af van de oplossing |
Veiligheid en gevaren van zinkcitraat
Trizinkcitraat wordt over het algemeen als veilig beschouwd bij gebruik in voedingssupplementen in de aanbevolen doseringen. Overmatige consumptie kan echter leiden tot nadelige effecten zoals maagklachten of maag-darmproblemen. Buiten bereik van kinderen houden en contact met de ogen of de huid vermijden. In geval van accidentele inname of een bijwerking, dient u onmiddellijk medische hulp in te roepen. Hoewel trizinkcitraat niet erg giftig is, is het belangrijk om het op verantwoorde wijze te gebruiken en de aanbevolen richtlijnen te volgen om mogelijke gevaren te voorkomen.
| Gevarensymbolen | Niet toepasbaar |
| Beveiligingsbeschrijving | Over het algemeen als veilig beschouwd bij gebruik in voedingssupplementen in de aanbevolen doseringen. Overmatige consumptie kan leiden tot maagklachten of maag-darmproblemen. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | Niet toepasbaar |
| Gevarenklasse | Niet geclassificeerd als gevaarlijk |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Niet erg giftig; volg de aanbevolen richtlijnen voor gebruik en dosering. |
Houd er rekening mee dat bepaalde eigenschappen, zoals gevarensymbolen, VN-identificaties, HS-code en verpakkingsgroep, mogelijk niet van toepassing zijn op Trizinkcitraat, omdat het in het algemeen niet als gevaarlijk wordt geclassificeerd bij zijn gebruikelijke toepassingen.
Methoden schrijven voor de synthese van zinkcitraat
Trizinkcitraat kan op verschillende manieren worden gesynthetiseerd. Een gebruikelijke aanpak is om citroenzuur te laten reageren met zinkoxide of zinkcarbonaat in een waterige oplossing. De reactie vormt trizinkcitraat en water als bijproducten. Een andere methode gebruikt citroenzuur en zinkacetaat als grondstoffen, waardoor met azijnzuur de gewenste verbinding ontstaat. Deze reacties vinden doorgaans plaats onder gecontroleerde temperatuur- en pH-omstandigheden om een optimale productvorming te garanderen.
Een andere methode is de neutralisatiereactie waarbij citroenzuur wordt geneutraliseerd met zinkhydroxide of zinkcarbonaat, wat resulteert in de vorming van trizinkcitraat en water. Deze methode vereist een zorgvuldige controle van de verhoudingen van de reactanten om het gewenste product te verkrijgen.
Precipitatiemethoden omvatten het mengen van een oplossing van een zinkzout (zoals zinksulfaat) met een oplossing die citraationen bevat. Dit leidt tot de vorming van onoplosbaar trizinkcitraat, dat vervolgens kan worden gescheiden en gezuiverd.
Over het geheel genomen benadrukken deze synthetische methoden het belang van nauwkeurige reagensverhoudingen en reactieomstandigheden om efficiënt trizinkcitraat van hoge kwaliteit te verkrijgen.
Gebruik van zinkcitraat
Trizinkcitraat vindt veelzijdige toepassingen vanwege zijn gunstige eigenschappen. Enkele veel voorkomende toepassingen zijn:
- Voedingssupplementen: Voedingssupplementen gebruiken trizinkcitraat omdat het de potentie heeft om de immuunfunctie te ondersteunen, wondgenezing te bevorderen en een gezonde huid te bevorderen.
- Mondgezondheidsproducten: Tandpasta- en mondwaterformuleringen bevatten trizinkcitraat als bestanddeel. De antimicrobiële eigenschappen helpen de opbouw van tandplak te voorkomen en de mondhygiëne te behouden.
- Producten voor persoonlijke verzorging: Cosmetica en huidverzorgingsproducten bevatten trizinkcitraat om de talgproductie te reguleren en huidonvolkomenheden te minimaliseren.
- Farmaceutische formuleringen: Sommige medicijnen bevatten trizinkcitraat vanwege zijn rol bij de opname van voedingsstoffen en het ondersteunen van de algehele gezondheid.
- Voedsel en dranken: Voedseladditieven worden in verschillende producten gebruikt als voedingsversterkers en zuurteregelaars.
- Metaaloppervlaktebehandeling: Industriële toepassingen gebruiken trizinkcitraat om metalen oppervlakken te behandelen, waardoor de corrosieweerstand wordt verbeterd.
- Verzinken: Trizinkcitraat draagt bij aan het verzinkproces, voorkomt corrosie en verlengt de levensduur van metalen voorwerpen.
- Bron van zinkionen: Diverse chemische en biologische onderzoeken gebruiken het als bron van zinkionen.
- Textielindustrie: Bij textielafwerkingsprocessen wordt trizinkcitraat gebruikt vanwege het vermogen om antimicrobiële eigenschappen aan stoffen te verlenen.
- Waterbehandeling: Bij waterbehandeling helpt het onzuiverheden zoals zware metalen neer te slaan en te verwijderen.
- Gebruik in de landbouw: Trizinkcitraat kan worden gebruikt als bladbespuiting om planten van Zn-suppletie te voorzien.
Deze toepassingen benadrukken het brede nut van trizinkcitraat in verschillende industrieën, vanwege de diverse eigenschappen en potentiële gezondheidsvoordelen.
Vragen:
Vraag: Waar worden calciumcitraat, magnesium en zink voor gebruikt?
A: Deze combinatie ondersteunt de gezondheid van de botten, de spierfunctie en het immuunsysteem, waarbij elk element bijdraagt aan verschillende fysiologische processen.
Vraag: Wat is zinkcitraat?
A: Trizinkcitraat is een verbinding van zink en citroenzuur, die vaak in supplementen wordt gebruikt vanwege de potentiële gezondheidsvoordelen, zoals ondersteuning van het immuunsysteem.
Vraag: Wat is het verschil tussen zinkcitraat en zinkchelaat?
A: Trizinkcitraat wordt gevormd door Zn aan citroenzuur te binden, terwijl bij Zn-chelaat het Zn aan een chelaatvormer wordt gebonden, waardoor de absorptie gemakkelijker wordt.
Vraag: Hoe zinkcitraatpoeder gebruiken?
A: Meng over het algemeen de aanbevolen dosis trizinkcitraatpoeder met water of een drankje, volgens de aanwijzingen op het productetiket.
Vraag: Zijn door de natuur gemaakte calcium-, magnesium- en zinksupplementen gemaakt met calciumcitraat?
A: Natuurlijk gemaakte supplementen kunnen calciumcitraat bevatten, maar het is raadzaam om het etiket of de productinformatie te controleren om dit te bevestigen.
Vraag: Is zinkcitraat synthetisch?
A: Trizinkcitraat kan worden gesynthetiseerd, maar het komt ook van nature voor in en kan worden afgeleid van bepaalde voedingsmiddelen.
Vraag: Waar komt zinkcitraat vandaan?
A: Trizinkcitraat kan worden verkregen uit natuurlijke bronnen of worden gesynthetiseerd via chemische reacties waarbij zinkverbindingen en citroenzuur betrokken zijn.
Vraag: Is zinkcitraattrihydraat organisch?
A: Trizinkcitraat-trihydraat kan worden gesynthetiseerd of uit natuurlijke bronnen worden gewonnen, maar het is niet geclassificeerd als “biologisch” in de zin van biologische landbouwpraktijken.
Vraag: Is zinkcitraat goed?
A: Trizinkcitraat wordt als gunstig beschouwd voor verschillende aspecten van de gezondheid, waaronder ondersteuning van het immuunsysteem, de gezondheid van de huid en het algehele welzijn, indien gebruikt zoals voorgeschreven.
