Zinkchromaat (ZnCrO4) is een corrosiebestendige verbinding die wordt gebruikt in coatings en primers. Het beschermt metalen, zoals vliegtuigonderdelen, tegen roest en degradatie, waardoor hun levensduur en structurele integriteit worden verlengd.
| IUPAC-naam | Zinkchromaat |
| Moleculaire formule | ZnCrO4 |
| CAS-nummer | 13530-65-9 |
| Synoniemen | Zinkgeel, zinkgeel 36, zinkchromaat (VI), trizinkdicitratotrichromaat, zinktetroxychromaat |
| InChi | InChI=1S/4Cr.3O.Zn/q;;;3*-1; |
Eigenschappen van zinkchromaat
Zinkchromaatformule
De chemische formule voor zinktetroxychromaat is ZnCrO4. Het bestaat uit één zinkatoom (Zn), één chroomatoom (Cr) en vier zuurstofatomen (O).
Zinkchromaat Molaire Massa
De molaire massa van zinktetroxychromaat (ZnCrO4) is ongeveer 181,38 g/mol. Het wordt berekend door de atoommassa’s van zink, chroom en zuurstof die in de verbinding aanwezig zijn, op te tellen.
Kookpunt van zinkchromaat
Zinktetroxychromaat heeft geen duidelijk kookpunt omdat het ontleedt voordat het zijn kookpunt bereikt. Bij verhitting ondergaat het thermische ontbinding, waarbij giftige dampen vrijkomen.
Smeltpunt van zinkchromaat
Zinktetroxychromaat heeft een smeltpunt van ongeveer 345°C (653°F). Bij deze temperatuur verandert de vaste verbinding in de vloeibare toestand.
Dichtheid van zinkchromaat g/ml
De dichtheid van zinktetroxychromaat is ongeveer 3,18 g/ml. Deze waarde geeft de massa van de verbinding per volume-eenheid aan en wordt vaak gebruikt om de fysieke eigenschappen ervan te karakteriseren.
Zinkchromaat Moleculair gewicht
Het molecuulgewicht van zinktetroxychromaat is 181,38 g/mol. Het vertegenwoordigt de som van de atoomgewichten van alle elementen die aanwezig zijn in de chemische formule van de verbinding.
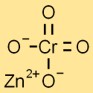
Structuur van zinkchromaat
Zinktetroxychromaat neemt over het algemeen een tetragonale kristalstructuur aan. Het bestaat uit Zn2+-kationen en CrO4^2-anionen die bij elkaar worden gehouden door elektrostatische krachten.
Oplosbaarheid van zinkchromaat
Zinktetroxychromaat heeft een beperkte oplosbaarheid in water. Het vormt een colloïdale suspensie wanneer het wordt gemengd met water vanwege de lage oplosbaarheid. De oplosbaarheid van de verbinding kan variëren afhankelijk van de temperatuur en de pH.
| Verschijning | Gele vaste stof |
| Soortelijk gewicht | 3,18 g/cm³ |
| Kleur | GEEL |
| Geur | Geurloos |
| Molaire massa | 181,38 g/mol |
| Dikte | 3,18 g/ml |
| Fusie punt | 345°C (653°F) |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Begrenzing |
| Oplosbaarheid | Beperkt in water, oplosbaar in zuren |
| Dampdruk | Onbelangrijk |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Basis |
Veiligheid en gevaren van zinkchromaat
Zinktetroxychromaat brengt aanzienlijke veiligheidsrisico’s met zich mee vanwege de toxische aard ervan. Inademing of inslikken kan ademhalings- en maag-darmproblemen veroorzaken. Het is irriterend voor de huid en ogen. Langdurige blootstelling kan ernstige gezondheidsproblemen veroorzaken. Bij het hanteren ervan zijn voldoende ventilatie, beschermende kleding en uitrusting essentieel. De verwijdering moet voldoen aan de regelgeving die gericht is op het voorkomen van milieuschade. Er worden veiliger alternatieven aanbevolen vanwege de nadelige gevolgen voor de gezondheid en het milieu.
| Gevarensymbolen | Irriterend, gevaar voor de gezondheid |
| Beveiligingsbeschrijving | Giftig; Schadelijk bij inademing, inslikken of bij contact met de huid/ogen. Voorkom lozing in het milieu. Gebruik persoonlijke beschermingsmiddelen. |
| VN-identificatienummers | VN1479 |
| HS-code | 3206.11.00 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | II (Gematigd gevaar) |
| Toxiciteit | Kan bij blootstelling ernstige gevolgen voor de gezondheid veroorzaken. Kankerverwekkend en schadelijk voor het waterleven. Wees voorzichtig en minimaliseer blootstelling. |
Zinkchromaatsynthesemethoden
Zinktetroxychromaat kan op verschillende manieren worden gesynthetiseerd. Een gebruikelijke aanpak is om zinkoxide (ZnO) en chroomtrioxide (CrO3) in een waterige oplossing te laten reageren. Zinkoxide lost op en vormt zinkhydroxide , terwijl chroomtrioxide reageert om chroomzuur te vormen. Deze oplossingen worden vervolgens gemengd, wat leidt tot de vorming van zinktetroxychromaatprecipitaten. De neerslagen worden vervolgens gescheiden, gewassen en gedroogd om het eindproduct te verkrijgen.
Een andere methode is de reactie tussen ZnSO4 en natriumchromaat (Na2CrO4) . Deze verbindingen worden opgelost in water om hun respectievelijke ionen te vormen. Het mengen van deze oplossingen resulteert in de precipitatie van zinktetroxychromaat. Het neerslag wordt verzameld, gewassen en gedroogd.
Het is van cruciaal belang om deze synthetische processen op een gecontroleerde manier uit te voeren vanwege de toxische aard van de betrokken verbindingen. Bovendien zijn passende veiligheidsmaatregelen en beschermende uitrusting noodzakelijk om de blootstelling aan gevaarlijke materialen tot een minimum te beperken. Deze methoden maken de productie mogelijk van zinktetroxychromaat, dat in verschillende industriële toepassingen wordt gebruikt ondanks de gezondheids- en milieuproblemen die daarmee gepaard gaan.
Gebruik van zinkchromaat
Zinktetroxychromaat wordt in verschillende toepassingen gebruikt vanwege zijn unieke eigenschappen, ondanks de gezondheids- en milieuproblemen die ermee gepaard gaan. Het gebruik ervan omvat:
- Corrosieremming: Zinktetroxychromaat dient als corrosieremmer in coatings, primers en verven voor metalen zoals staal en aluminium. Het vormt een beschermlaag die oxidatie voorkomt en de levensduur van het metaal verlengt.
- Lucht- en ruimtevaartindustrie: De lucht- en ruimtevaartsector gebruikt zinktetroxychromaat om vliegtuigonderdelen tegen corrosie te beschermen. De duurzaamheid en weerstand tegen extreme omstandigheden maken het geschikt voor luchtvaartcoatings.
- Maritieme coatings: In maritieme omgevingen, waar metalen te maken krijgen met zout water en vochtigheid, werken zinktetroxychromaatcoatings als een schild en voorkomen ze roest en bederf.
- Pigmenten en kleurstoffen: De heldergele tint van zinktetroxychromaat is nuttig in pigmenten en kleurstoffen voor kunststoffen, textiel en kunstmaterialen.
- Houtconserveringsmiddelen: Zinktetroxychromaat beschermt tegen schimmelrot en insectenplagen bij houtbehandelingen, waardoor de levensduur van houten constructies wordt verlengd.
- Galvaniseren: zinktetroxychromaat wordt gebruikt bij galvaniseerprocessen en geeft een beschermende en decoratieve laag aan verschillende metalen voorwerpen.
- Auto-industrie: Zinktetroxychromaat vindt zijn weg in autocoatings, biedt bescherming tegen de elementen en verbetert de visuele aantrekkingskracht van voertuigen.
- Corrosietesten: Laboratoria gebruiken het als referentiemateriaal om de corrosieweerstand van materialen en coatings te evalueren.
- Industriële primers: In industriële omgevingen worden primers met zinktetroxychromaat op metalen oppervlakken aangebracht, waardoor een basislaag ontstaat voor daaropvolgende verftoepassingen.
Vragen:
Vraag: Waar kan ik zinkchromaatprimer kopen?
A: Zinktetroxychromaatprimer kan worden gekocht bij bouwmarkten, online winkels en leveranciers van speciale coatings.
Vraag: Is zinkchromaat oplosbaar?
A: Zinktetroxychromaat heeft een beperkte oplosbaarheid in water en vormt een colloïdale suspensie.
Vraag: Welke kleur heeft zinkchromaat?
A: Zinktetroxychromaat is over het algemeen geel van kleur.
Vraag: Hoe lang moet zinkchromaat drogen?
A: De droogtijd van de zinktetroxychromaatprimer kan variëren, maar het duurt doorgaans enkele uren voordat deze aanvoelt.
Vraag: Zal hysol aan zinkchromaat blijven plakken?
A: Ja, Hysol-lijmen kunnen goed hechten op zinktetroxychromaatoppervlakken.
Vraag: Is het oké om zinkchromaat aan te raken?
A: Het is het beste om direct contact met zinktetroxychromaat te vermijden, omdat het schadelijk kan zijn vanwege de toxiciteit ervan.
Vraag: Hecht West System epoxy aan zinkchromaatprimer?
A: Ja, het is bekend dat West System epoxy effectief hecht aan goed voorbereide zinktetroxychromaatprimers.
Vraag: Wat is de naam van de verbinding met de formule ZnCrO4?
A: De verbinding met de formule ZnCrO4 wordt zinktetroxychromaat genoemd.
Vraag: Is ZnCrO4 ionisch of covalent?
A: ZnCrO4 is een ionische verbinding.
Vraag: Is ZnCrO4 oplosbaar in water?
A: ZnCrO4 heeft een beperkte oplosbaarheid in water.
Vraag: Is ZnCrO4 ionisch of moleculair?
A: ZnCrO4 is een ionische verbinding.
