Zinkcarbonaat (ZnCO3) is een witte, geurloze vaste stof die wordt gevormd door de reactie van zink met carbonaationen. Vanwege zijn unieke eigenschappen wordt het gebruikt in verschillende toepassingen, zoals keramiek en farmaceutische producten.
| IUPAC-naam | Zinkcarbonaat |
| Moleculaire formule | ZnCO3 |
| CAS-nummer | 3486-35-9 |
| Synoniemen | Zink(II)carbonaat; Smithsoniet; Koolzuurhoudend zink; Zinkcarbonaat |
| InChi | InChI=1S/CH2O3.Zn/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Eigenschappen van zinkcarbonaat
Zinkcarbonaatformule
De chemische formule voor zinkcarbonaat is ZnCO3. Het bestaat uit één zinkatoom (Zn), één koolstofatoom (C) en drie zuurstofatomen (O). Deze verbinding is een witte, geurloze vaste stof en wordt in de natuur vaak aangetroffen als het mineraal smithsoniet.
Zinkcarbonaat molaire massa
De molaire massa van zinkcarbonaat kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. Zink heeft een molaire massa van ongeveer 65,38 g/mol, koolstof 12,01 g/mol en zuurstof 16,00 g/mol (ongeveer). De molaire massa van zinkcarbonaat is dus ongeveer 125,38 g/mol.
Kookpunt van zinkcarbonaat
Zinkcarbonaat heeft geen duidelijk kookpunt, omdat het bij verhitting ontleedt, waarbij kooldioxide vrijkomt en zinkoxide (ZnO) achterblijft. Het is echter stabiel tot temperaturen rond de 300°C.
Zinkcarbonaat smeltpunt
Het smeltpunt van zinkcarbonaat ligt rond de 333°C (ongeveer). Bij deze temperatuur ondergaan zinkcarbonaten thermische ontleding en vormen zinkoxide en kooldioxide.
Dichtheid van zinkcarbonaat g/ml
De dichtheid van zinkcarbonaat is ongeveer 4,398 g/ml. Deze waarde geeft aan dat zinkcarbonaat een relatief dichte vaste stof is vergeleken met veel andere verbindingen.
Zinkcarbonaat Molecuulgewicht
Het molecuulgewicht van zinkcarbonaat, ook wel molmassa genoemd, is ongeveer 125,38 g/mol. Het is de massa van één mol zinkcarbonaatmoleculen en wordt gebruikt in verschillende chemische berekeningen.
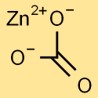
Structuur van zinkcarbonaat
Zinkcarbonaat heeft een trigonale kristalstructuur. Het zinkkation (Zn2+) is omgeven door carbonaatanionen (CO32-) in een trigonale vlakke opstelling. Deze opstelling geeft zinkcarbonaat zijn unieke fysische en chemische eigenschappen.
Oplosbaarheid van zinkcarbonaat
Zinkcarbonaat is slecht oplosbaar in water. De oplosbaarheid neemt af bij afnemende temperatuur en toenemende pH. Het kan ook oplossen in zure oplossingen vanwege de vorming van oplosbare zinkzouten. Het vormt echter onoplosbare neerslagen in aanwezigheid van carbonaten of hydroxiden.
| Verschijning | Witte vaste stof |
| Soortelijk gewicht | 4.398 g/ml (ongeveer) |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 125,38 g/mol |
| Dikte | 4.398 g/ml (ongeveer) |
| Fusie punt | 333°C (ongeveer) |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Slecht oplosbaar |
| Oplosbaarheid | Onoplosbaar in de meeste oplosmiddelen, kan ook oplossen in zure oplossingen |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Licht alkalisch (ongeveer 8-9) |
Veiligheid en gevaren van zinkcarbonaat
Zinkcarbonaat brengt bepaalde veiligheidsrisico’s met zich mee die speciale aandacht vereisen. Het kan de huid, ogen en luchtwegen irriteren bij contact of inademing. Vermijd inname, aangezien dit maag-darmklachten kan veroorzaken. Draag bij het hanteren geschikte persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril, om direct contact te voorkomen. Bewaar zinkcarbonaat op een koele, droge plaats, uit de buurt van onverenigbare stoffen. In geval van inslikken of accidentele blootstelling, dient u onmiddellijk medische hulp in te roepen. Volg bovendien de juiste afvalverwijderingsprocedures voor dit mengsel om de impact op het milieu te minimaliseren. De juiste hanterings- en opslagpraktijken zijn essentieel om een veilig gebruik van zinkcarbonaat in verschillende toepassingen te garanderen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Schadelijk bij inslikken of inademen. Irriterend voor de huid en ogen. Vermijd contact. Gebruiken met voldoende ventilatie. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 28369900 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage tot matige toxiciteit |
Zinkcarbonaatsynthesemethoden
Zinkcarbonaat kan op verschillende manieren worden gesynthetiseerd. Een gebruikelijke aanpak is om zinkoxide (ZnO) te laten reageren met kooldioxide (CO2) in aanwezigheid van water of een geschikt oplosmiddel. De reactie kan worden uitgevoerd bij een gecontroleerde temperatuur en druk om de vorming van zinkcarbonaat te bevorderen.
Een andere methode omvat de reactie van zinkchloride (ZnCl2) of zinksulfaat (ZnSO4) met natriumcarbonaat (Na2CO3) of kaliumcarbonaat (K2CO3) in een waterige oplossing. Bij dit proces ontstaat zinkcarbonaat als neerslag, dat kan worden afgescheiden en opgevangen.
Bovendien kan zinkcarbonaat worden verkregen door carbonatatie van zinkhydroxide (Zn(OH)2) of zinkoxide met kooldioxide, hetzij in gasvorm, hetzij opgelost in water.
In industriële omgevingen wordt zinkcarbonaat vaak geproduceerd als bijproduct van de zinkverwerking of als resultaat van reacties waarbij zinkhoudende materialen betrokken zijn.
Het is essentieel om tijdens de synthese de juiste stoichiometrie en reactieomstandigheden te garanderen om een puur en kwalitatief hoogstaand product te verkrijgen. De keuze voor de methode is afhankelijk van factoren als de beschikbaarheid van reagentia, de gewenste zuiverheid van het product en de beoogde toepassing van het zinkcarbonaat.
Gebruik van zinkcarbonaat
Zinkcarbonaat vindt vanwege zijn unieke eigenschappen diverse toepassingen in diverse industrieën. Hier zijn enkele opmerkelijke toepassingen:
- Keramiek: Zinkcarbonaat verlaagt actief het smeltpunt van materialen en verbetert hun glans en transparantie bij gebruik als vloeimiddel in keramische glazuren.
- Farmaceutische producten: Bij medicinale toepassingen dient zinkcarbonaat als actief ingrediënt in sommige antiseptische en adstringerende formuleringen.
- Verven: Zinkcarbonaat functioneert actief als een wit pigment in verven en coatings en zorgt voor glans en uitstekende dekkracht.
- Rubberindustrie: Tijdens het vulkanisatieproces werkt zinkcarbonaat als versneller, waardoor de mechanische eigenschappen van rubberproducten actief worden verbeterd.
- Textielindustrie: Als beitsmiddel verbetert zinkcarbonaat actief de retentie van kleurstoffen op stoffen tijdens het verfproces.
- Elektronica: zinkcarbonaat wordt dankzij zijn elektrische eigenschappen actief toegepast in elektronische componenten en als coatingmateriaal voor halfgeleiders.
- Landbouw: Zinkcarbonaat functioneert actief als fungicide en schimmelpreventie voor gewassen.
- Glasfabricage: Bij het maken van glas werkt zinkcarbonaat als een vloeimiddel, waardoor het smeltpunt van glas actief wordt verlaagd en de helderheid ervan wordt verbeterd.
- Additief voor diervoeding: Fabrikanten voegen actief zinkcarbonaat toe aan diervoer als een cruciale bron van essentieel zink, dat de algehele gezondheid van vee actief ondersteunt.
- Waterbehandeling: Waterbehandelingsfaciliteiten maken actief gebruik van zinkcarbonaat in hun processen om de pH-niveaus actief te controleren en actief onzuiverheden van zware metalen te verwijderen.
De veelzijdigheid van zinkcarbonaat in verschillende industrieën onderstreept het belang ervan als waardevolle verbinding met een breed scala aan praktische toepassingen.
Vragen:
Vraag: Is ZnCO3 oplosbaar in water?
A: Zinkcarbonaat is slecht oplosbaar in water.
Vraag: Welke reactie zal het meest waarschijnlijk optreden? Pt + FeCl3 Mn + CaO Li + ZnCO3 Cu + 2KNO3
A: De meest waarschijnlijke reactie is Li + ZnCO3.
Vraag: Welke massa ZnCO3 bevat 3,11×10^22 O-atomen?
A: De massa van ZnCO3 met 3,11×10^22 O-atomen kan worden berekend op basis van de molaire massa en stoichiometrie van de verbinding.
Vraag: Wat is de naam van ZnCO3?
A: De naam van ZnCO3 is zinkcarbonaat.
Vraag: Welke van de volgende verbindingen is oplosbaar in water? Cu3(PO4)2, CoS, Pb(NO3)2, ZnCO3?
A: ZnCO3 is slecht oplosbaar in water.
Vraag: Welk type binding ontstaat er tussen ZnCO3?
A: Ionische bindingen vormen zich tussen ZnCO3.
Vraag: Is zinkcarbonaat oplosbaar in water?
A: Zinkcarbonaat is slecht oplosbaar in water.
Vraag: Wat is een koolstof-zinkbatterij?
A: Een koolstof-zinkbatterij is een soort droge batterij die gebruik maakt van een zinkanode en een koolstofkathode met een elektrolytische pasta.
Vraag: Waarin verschilt een alkalische batterij van een droge zink-koolstofbatterij?
A: Alkalinebatterijen hebben een hogere energiedichtheid en een langere levensduur dan droge zinkkoolstofbatterijen, dankzij het gebruik van een alkalisch elektrolyt.
Vraag: Wat is het verschil tussen koolstof-zink- en alkalibatterijen?
A: Koolstof-zinkbatterijen hebben een lagere energiecapaciteit en een kortere levensduur dan alkalibatterijen vanwege verschillen in elektrolyt en constructie.
Vraag: Kun je koolstof-zinkbatterijen gebruiken in plaats van alkalische batterijen?
A: Ja, maar koolstof-zinkbatterijen hebben mogelijk een kortere levensduur en zijn minder geschikt voor apparaten met een hoog verbruik dan alkalibatterijen.
