Zinkbromide (ZnBr2) is een chemische verbinding. Het bestaat uit de elementen zink en broom. Het wordt gebruikt in verschillende toepassingen, zoals olieboorvloeistoffen en elektrolytoplossingen.
| IUPAC-naam | Zinkbromide |
| Moleculaire formule | ZnBr2 |
| CAS-nummer | 7699-45-8 |
| Synoniemen | Zinkdibromide, zink (II)bromide |
| InChi | InChI=1S/2BrH.Zn/h2*1H;/q;;+2/p-2 |
Eigenschappen van zinkbromide
Zinkbromide-formule
De formule voor zinkdibromide is ZnBr2. Het bestaat uit één zinkatoom (Zn) en twee broomatomen (Br). Deze verbinding wordt gevormd door de combinatie van deze elementen.
Zinkbromide Molaire Massa
Zinkdibromide heeft een molaire massa van ongeveer 225,19 g/mol. Deze waarde wordt berekend door de atoommassa’s van één zinkatoom en twee broomatomen in de verbinding op te tellen.
Kookpunt van zinkbromide
Het kookpunt van zinkdibromide is ongeveer 464°C (867°F). Bij deze temperatuur verandert de verbinding van de vloeibare toestand naar de gasvormige toestand. Dit hoge kookpunt maakt het geschikt voor bepaalde industriële toepassingen.
Smeltpunt van zinkbromide
Zinkdibromide heeft een smeltpunt van ongeveer 394°C (741°F). Dit is de temperatuur waarbij de vaste verbinding overgaat in de vloeibare toestand. Het relatief hoge smeltpunt is te wijten aan de sterke interacties tussen de zink- en broomatomen.
Dichtheid van zinkbromide g/ml
De dichtheid van zinkdibromide is ongeveer 4,20 g/ml. Deze waarde geeft de massa van de verbinding per volume-eenheid aan. De hoge dichtheid suggereert dat zinkdibromide relatief zwaar is in verhouding tot zijn volume.
Zinkbromide Moleculair gewicht
Het molecuulgewicht van zinkdibromide is ongeveer 225,19 g/mol. Deze waarde vertegenwoordigt de som van de atoomgewichten van alle atomen in een enkel molecuul van de verbinding.
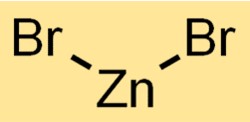
Structuur van zinkbromide
Zinkdibromide heeft een kristallijne structuur. Het vormt een netwerk waarin zinkkationen (Zn2+) in een zich herhalend patroon worden omgeven door bromide-anionen (Br-). Deze structuur draagt bij aan de eigenschappen en het gedrag van de verbinding.
Oplosbaarheid van zinkbromide
Zinkdibromide is zeer oplosbaar in water. Wanneer het aan water wordt toegevoegd, valt het uiteen in zinkkationen en bromide-anionen, waardoor een oplossing ontstaat. Deze oplosbaarheid is voordelig bij een verscheidenheid aan toepassingen, waaronder het gebruik ervan als elektrolyt in batterijen en bij de formulering van boorvloeistoffen voor de aardolie-industrie.
| Verschijning | Witte vaste stof |
| Soortelijk gewicht | 4,20 g/ml |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 225,19 g/mol |
| Dikte | 4,20 g/ml |
| Fusie punt | 394°C (741°F) |
| Kookpunt | 464°C (867°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar, dissocieert in zinkkationen en bromide-anionen |
| Oplosbaarheid | Oplosbaar in water |
| Dampdruk | Niet goed gedefinieerd |
| Dampdichtheid | Niet toepasbaar |
| pKa | ~3,8 |
| pH | Zuur |
Veiligheid en gevaren van zinkbromide
Zinkdibromide brengt enkele veiligheidsrisico’s met zich mee. Het kan bij contact huid- en oogirritatie veroorzaken. Inademing van stof of dampen kan ademhalingsproblemen veroorzaken. Het is essentieel om er voorzichtig mee om te gaan en beschermende uitrusting te dragen, zoals handschoenen en een bril. In geval van contact met de huid, wassen met water en een arts raadplegen als de irritatie aanhoudt. Bij inslikken onmiddellijk medische hulp inroepen. Houd het uit de buurt van onverenigbare materialen, sterke zuren en basen. Opslaan in een goed geventileerde ruimte, uit de buurt van open vuur of warmtebronnen. Over het algemeen is het van cruciaal belang om de juiste veiligheidsmaatregelen te volgen bij de omgang met zinkdibromide om potentiële risico’s te vermijden.
| Gevarensymbolen | Bijtend, schadelijk bij inslikken |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. Draag beschermende kleding en handschoenen. Bij contact grondig afspoelen. Inademing van stof/damp kan irritatie van de luchtwegen veroorzaken. Opslaan in een goed geventileerde ruimte. Voorkom lozing in het milieu. Gooi het op de juiste manier weg. |
| VN-identificatienummers | UN3264 |
| HS-code | 28275900 |
| Gevarenklasse | 8 (Bijtende stoffen) |
| Verpakkingsgroep | II |
| Toxiciteit | Matig giftig |
Methoden voor de synthese van zinkbromide
Zinkdibromide kan op verschillende manieren worden gesynthetiseerd. Een gebruikelijke methode is om zinkoxide (ZnO) te laten reageren met broomwaterstofzuur (HBr) . De reactie produceert zinkdibromide en water:
ZnO + 2HBr → ZnBr2 + H2O
Een andere benadering is de directe reactie van metallisch zink met gasvormig broom (Br2). Deze methode levert zinkdibromide op:
Zn + Br2 → ZnBr2
Zinkdibromide kan ook worden bereid door zinkcarbonaat (ZnCO3) te behandelen met broomwaterstofzuur :
ZnCO3 + 2HBr → ZnBr2 + H2O + CO2
Bovendien kan de reactie van zinkoxide met waterstofbromidegas (HBr) zinkdibromide genereren:
ZnO + 2HBr → ZnBr2 + H2O
Deze synthesemethoden resulteren in de vorming van zinkdibromide, een essentiële verbinding met verschillende industriële toepassingen, waaronder het gebruik ervan in elektrolytoplossingen en olieboorvloeistoffen.
Gebruik van zinkbromide
Zinkdibromide vindt verschillende belangrijke toepassingen in verschillende sectoren vanwege zijn unieke eigenschappen:
- Chemische synthese: ZnBr2 dient als katalysator bij chemische reacties. Het bevordert specifieke reacties in organische synthese en farmaceutische productieprocessen.
- Fotografie: Bij sommige fotografische processen fungeert ZnBr2 als een lichtgevoelig materiaal, dat bijdraagt aan de productie van fotografisch papier en films.
- Olie- en gasindustrie: ZnBr2 speelt een centrale rol in boorvloeistoffen voor olie en gas, waarbij de druk wordt gehandhaafd, uitbarstingen van putten worden voorkomen en het boren wordt gestabiliseerd.
- Batterij-elektrolyt: Sommige soorten batterijen, waaronder zink-broomstroombatterijen, gebruiken ZnBr2 als elektrolyt en dienen in energieopslag- en back-upstroomsystemen.
- Medicinale innovaties: Onderzoekers onderzoeken het potentieel van ZnBr2 in farmaceutische producten en medicijnen vanwege de antimicrobiële eigenschappen ervan, waarbij toepassingen in wondgenezing en infectiebeheersing worden overwogen.
- Textielverbetering: ZnBr2 wordt gebruikt bij het verven en bedrukken van textiel door specifieke kleurstoffen aan stoffen te helpen hechten, waardoor de kleurechtheid wordt verbeterd.
- Vlamvertragende formuleringen: ZnBr2 wordt een additief in vlamvertragende formuleringen voor kunststoffen en textiel, waardoor de ontvlambaarheid van deze materialen effectief wordt verminderd.
- Metaaloppervlakbehandeling: ZnBr2 neemt deel aan metaaloppervlakbehandelingen, gebruikt bij reinigings- en etsprocessen die oppervlakken voorbereiden op daaropvolgende coatings of behandelingen.
De veelzijdige aard van ZnBr2 maakt het tot een waardevolle stof op verschillende gebieden, die bijdraagt aan technologische vooruitgang en industriële processen.
Vragen:
Vraag: Is zinkbromide oplosbaar?
A: Ja, zinkdibromide is zeer oplosbaar in water.
Vraag: Is zinkbromide ionisch of covalent?
A: Zinkdibromide is een ionische verbinding.
Vraag: Hoe ziet zinkbromide eruit?
A: Zinkdibromide verschijnt als een witte kristallijne vaste stof.
Vraag: Wat is de formule voor zinkbromide?
A: De formule voor zinkdibromide is ZnBr2.
Vraag: Is ZnBr2 oplosbaar in water?
A: Ja, ZnBr2 is oplosbaar in water.
Vraag: Wat is ZnBr2?
A: ZnBr2 is een chemische verbinding, zinkdibromide.
Vraag: Is ZnBr2 ionisch of moleculair?
A: ZnBr2 is ionisch van aard.
Vraag: Welke massa ZnBr2 zou je kunnen bereiden uit 1,00 g zink?
A: Uit 1,00 g zink kunt u 1,76 g ZnBr2 bereiden.
Vraag: Lost ZnBr2 volledig op in water?
A: Ja, ZnBr2 lost volledig op in water.
Vraag: Welke producten worden er gevormd aan de kathode tijdens de elektrolyse van een waterige oplossing van ZnBr2?
A: Aan de kathode wordt metallisch zink gevormd tijdens de elektrolyse van ZnBr2.
Vraag: Wat blijft er over als ZnBr2 wordt opgelost in water?
A: Wanneer ZnBr2 in water wordt opgelost, blijven Zn²⁺-ionen en bromide-ionen (Br⁻) in de oplossing achter.
