Zinkacetaat (Zn(C2H3O2)2) is een chemische verbinding. Het gebruik ervan is talrijk in industrieën en laboratoria. Het is oplosbaar in water en kan witte kristalstructuren vormen.
| IUPAC-naam | Zinkacetaat |
| Moleculaire formule | Zn(C2H3O2)2 |
| CAS-nummer | 557-34-6 |
| Synoniemen | Zinkdiacetaat, zinkethanoaat, zinkzout van azijnzuur |
| InChi | InChI=1S/2C2H4O2.Zn/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Eigenschappen van zinkacetaat
Zinkacetaatformule
De chemische formule voor zinkethanoaat is Zn(C2H3O2)2. Het bestaat uit één zinkion (Zn) en twee acetaationen (C2H3O2). De formule vertegenwoordigt de verhouding van de atomen die in de verbinding aanwezig zijn.
Zinkacetaat molaire massa
De molaire massa van zinkethanoaat kan worden berekend door de atoommassa’s van elk element in de formule op te tellen. Voor zink (Zn) is de atoommassa 65,38 g/mol en voor acetaat (C2H3O2) 59,05 g/mol. De molaire massa van zinkethanoaat is dus ongeveer 183,39 g/mol.
Kookpunt van zinkacetaat
Zinkethanoaat heeft geen duidelijk kookpunt, omdat het bij verhitting de neiging heeft te ontleden en azijnzuur te verliezen. In plaats daarvan valt het bij hoge temperaturen uiteen in zinkoxide en azijnzuur.
Smeltpunt van zinkacetaat
Zinkethanoaat heeft een smeltpunt van ongeveer 237°C (459°F). Bij deze temperatuur verandert de vaste verbinding in de vloeibare toestand. Smeltpunt is een belangrijk kenmerk dat wordt gebruikt voor identificatie.
Dichtheid van zinkacetaat g/ml
De dichtheid van zinkethanoaat is ongeveer 1,84 g/ml. Dichtheid is de maatstaf voor de massa per volume-eenheid van een stof. De dichtheid van zinkethanoaat is relatief hoog, wat wijst op de compactheid ervan.
Zinkacetaat Molecuulgewicht
Het molecuulgewicht van zinkethanoaat is 183,39 g/mol. Het is de som van de atoomgewichten van alle atomen in de verbinding. Het molecuulgewicht is cruciaal voor verschillende chemische berekeningen en reacties.
Zinkacetaatstructuur
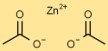
Zinkethanoaat heeft een eenvoudige structuur, waarbij het zinkion (Zn) in het midden wordt omringd door twee acetaationen (C2H3O2). Acetaationen vormen gecoördineerde covalente bindingen met het zinkion.
Oplosbaarheid van zinkacetaat
Zinkethanoaat is oplosbaar in water en andere polaire oplosmiddelen. De oplosbaarheid in water is relatief hoog en vormt een kleurloze oplossing. De oplosbaarheid van de verbinding is essentieel voor de verschillende toepassingen in industrieën en laboratoria.
| Eigendom | Waarde |
| Verschijning | Witte kristallen |
| Soortelijk gewicht | 1,84 g/ml |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 183,39 g/mol |
| Dikte | 1,84 g/cm³ |
| Fusie punt | 237°C (459°F) |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in water en andere polaire oplosmiddelen |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Neutraal (7) |
Veiligheid en gevaren van zinkacetaat
Zinkethanoaat brengt minimale veiligheidsrisico’s met zich mee als het op de juiste manier wordt behandeld. Dit kan lichte irritatie van de huid en ogen veroorzaken. Vermijd inademing of inslikken, omdat dit ademhalings- en maag-darmklachten kan veroorzaken. Bewaren op een koele, droge plaats, uit de buurt van onverenigbare stoffen. Draag geschikte beschermende uitrusting tijdens het hanteren. In geval van contact de getroffen gebieden met veel water afspoelen. Raadpleeg een arts als de irritatie aanhoudt. Volg goede laboratoriumpraktijken en veiligheidsinstructies om ongelukken te voorkomen. Hoewel het over het algemeen veilig is, zijn verantwoorde omgang en voorzorgsmaatregelen essentieel om een veilige werkomgeving te garanderen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Veroorzaakt lichte huidirritatie, Veroorzaakt oogirritatie, Vermijd inademing/inslikken. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 29152900 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit |
Zinkacetaatsynthesemethoden
Er zijn verschillende methoden voor het synthetiseren van zinkethanoaat. Een gebruikelijke aanpak omvat de reactie tussen zinkoxide (ZnO) en azijnzuur (CH3COOH) . De twee stoffen worden gemengd en de reactie vindt plaats bij hoge temperatuur. Tijdens het proces reageert zinkoxide met azijnzuur, wat resulteert in de vorming van zinkethanoaat en water.
Een andere methode omvat de reactie van metallisch zink met azijnzuur . Zinkmetaal wordt aan azijnzuur toegevoegd en de reactie vindt plaats, waarbij zinkethanoaat en waterstofgas worden geproduceerd.
Als alternatief kan zinkethanoaat worden bereid door zinkcarbonaat (ZnCO3) te laten reageren met azijnzuur. Zinkcarbonaat reageert met azijnzuur en produceert zinkethanoaat, kooldioxide en water.
Bovendien kan zinkethanoaat worden verkregen door zinkhydroxide (Zn(OH)2) te behandelen met azijnzuur. De reactie tussen deze stoffen levert zinkethanoaat en water op.
Ongeacht de gebruikte methode kan het resulterende zinkethanoaat verder worden gezuiverd door kristallisatie- of filtratieprocessen. Tijdens de synthese moet voorzichtigheid in acht worden genomen om de veiligheid te garanderen en een product van hoge kwaliteit te verkrijgen.
Gebruik van zinkacetaat
Zinkethanoaat vindt vanwege zijn veelzijdige eigenschappen een breed scala aan toepassingen in verschillende industrieën. Enkele veel voorkomende toepassingen zijn:
- Farmaceutische industrie: Zinkethanoaat draagt actief bij aan de immuunfunctie en wondgenezing, aangezien farmaceutische bedrijven het in verschillende medicijnen en voedingssupplementen verwerken om als bron van zink te voorzien.
- Textielindustrie: In de textielindustrie wordt het gebruikt als bijtmiddel bij verfprocessen om de kleurvastheid van textielkleurstoffen op stoffen te fixeren en te verbeteren.
- Chemische synthese: Zinkethanoaat fungeert als katalysator bij organische reacties en vergemakkelijkt veresterings- en acetyleringsprocessen.
- Houtbehoud: Houtbehandelingsformuleringen gebruiken zinkethanoaat om te beschermen tegen aantasting door schimmels en termieten, waardoor de levensduur van houtproducten wordt verlengd.
- Galvaniseren: Bij het verzinken dient zinkethanoaat als een voorloper bij de productie van zinkcoatings, waardoor het corrosieweerstand biedt tegen staal en andere metalen.
- Laboratoriumtoepassingen: Onderzoekers en wetenschappers gebruiken zinkethanoaat als reagens in verschillende laboratoriumexperimenten en analytische procedures.
- Huidverzorgingsproducten: Zalven en crèmes bevatten zinkethanoaat vanwege de samentrekkende en verzachtende eigenschappen, gunstig voor huidaandoeningen zoals acne.
- Ontdooier: In sommige gebieden wordt zinkethanoaat gebruikt als milieuvriendelijke ontdooier op wegen en trottoirs in de winter om ijsvorming te voorkomen.
- Gasontzwaveling: Zinkethanoaat vindt toepassing in gasreinigingsprocessen om zwavelverbindingen uit industriële emissies te verwijderen.
- Voedingsindustrie: In de voedingsindustrie fungeert zinkethanoaat als een voedseladditief en dient het als zuurteregelaar en stabilisator in sommige bewerkte voedingsmiddelen.
Over het geheel genomen tonen de verschillende toepassingen van zinkethanoaat het belang ervan in verschillende industrieën aan, waardoor het een waardevolle verbinding is in verschillende productie- en onderzoeksprocessen.
Vragen:
Vraag: Welke stof is belangrijk bij de vervaardiging van kunststoffen?
A: Azijnzuur is essentieel bij de productie van kunststoffen, omdat het vaak wordt gebruikt als grondstof bij de productie van verschillende synthetische polymeren.
Vraag: Wat is zinkacetaat?
A: Zinkethanoaat is een chemische verbinding die wordt gevormd door de reactie van zinkoxide of zinkmetaal met azijnzuur, resulterend in een witte kristallijne vaste stof.
Vraag: Wat is de formule van zinkacetaat?
A: De formule voor zinkethanoaat is Zn(C2H3O2)2.
Vraag: Is zinkacetaat oplosbaar?
A: Ja, zinkethanoaat is oplosbaar in water en andere polaire oplosmiddelen.
Vraag: Zijn zinkacetaat en zinkgluconaat anticoagulantia?
A: Nee, zinkethanoaat en zinkgluconaat zijn geen bloedverdunners. Dit zijn vormen van zink die worden gebruikt als voedingssupplementen.
Vraag: Is zinkazijnzuur een vaste stof?
A: Zinkazijnzuur is geen specifieke verbinding. Het kan verwijzen naar het reactieproduct van zink met azijnzuur, wat een vaste zinkverbinding zou zijn.
Vraag: Welk element en welke verbinding heeft dezelfde chemische reactie als zink en azijnzuur?
A: Het element is zink (Zn) en de verbinding is zinkoxide (ZnO), dat op dezelfde manier reageert als zink en azijnzuur.
Vraag: Wat is de uitgebalanceerde vergelijking voor zink en azijnzuur?
A: De gebalanceerde vergelijking is: Zn + 2CH3COOH → Zn(CH3COO)2 + H2.
Vraag: Wat doet zinkacetaat voor de huid?
A: Zinkethanoaat wordt in huidverzorgingsproducten gebruikt vanwege de adstringerende eigenschappen, waardoor huidaandoeningen zoals acne worden verzacht en verlicht.
