Zilvernitraat (AgNO3) is een chemische verbinding bestaande uit zilver, stikstof en zuurstof. Het wordt vaak gebruikt in de fotografie, de geneeskunde en als laboratoriumreagens voor verschillende reacties.
| IUPAC-naam | Zilvernitraat |
| Moleculaire formule | AgNO3 |
| CAS-nummer | 7761-88-8 |
| Synoniemen | Zilvermononitraat, zilver(1+) zout van salpeterzuur, zilver(I)nitraat |
| InChi | InChI=1S/Ag.NO3/c;2-1(3)4/q+1;-1 |
Eigenschappen van zilvernitraat
Zilvernitraatformule
De formule voor zilvermononitraat is AgNO3. Het bestaat uit één zilveratoom (Ag), één stikstofatoom (N) en drie zuurstofatomen (O). De formule vertegenwoordigt de verhouding van atomen in een molecuul zilvermononitraat.
Zilvernitraat Molaire Massa
De molaire massa van zilvermononitraat wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. Zilver heeft een atoommassa van 107,87 g/mol, stikstof heeft een massa van 14,01 g/mol en elk zuurstofatoom heeft een massa van 16,00 g/mol. Hun toevoeging levert een molaire massa op van ongeveer 169,87 g/mol voor zilvermononitraat.
Kookpunt van zilvernitraat
Zilvermononitraat heeft een kookpunt van ongeveer 440 graden Celsius (824 graden Fahrenheit). Bij deze temperatuur ondergaat de verbinding een faseovergang van een vloeibare toestand naar een gasvormige toestand. Het kookpunt geeft de temperatuur aan waarbij de dampspanning van de stof gelijk is aan de atmosferische druk.
Zilvernitraat Smeltpunt
Het smeltpunt van zilvermononitraat is ongeveer 209 graden Celsius (408 graden Fahrenheit). Dit is de temperatuur waarbij de vaste vorm van zilvermononitraat vloeibaar wordt. Het smeltpunt is een karakteristieke eigenschap van een stof en helpt bij het bepalen van het fysieke gedrag ervan onder verschillende omstandigheden.
Dichtheid van zilvernitraat g/ml
De dichtheid van zilvermononitraat is ongeveer 4,35 g/ml. Dichtheid is een maatstaf voor de hoeveelheid massa die zich in een bepaald volume bevindt. Het wordt berekend door de massa van een stof te delen door het volume. De dichtheid van zilvermononitraat geeft aan hoe compact het is of hoe geconcentreerd het is in een specifieke ruimte.
Zilvernitraat Molecuulgewicht
Het molecuulgewicht van zilvermononitraat, ook wel molmassa genoemd, bedraagt ongeveer 169,87 g/mol. Het vertegenwoordigt de som van de atoommassa’s van alle atomen in een molecuul zilvermononitraat. Het molecuulgewicht wordt gebruikt bij verschillende berekeningen en conversies waarbij hoeveelheden van de verbinding betrokken zijn.
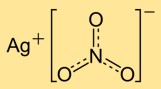
Structuur van zilvernitraat
Zilvermononitraat heeft een kristalstructuur bestaande uit zilverkationen (Ag+) en nitraatanionen (NO3-). De zilverionen zijn omgeven door nitraationen en vormen een regelmatig netwerk. Deze ionische structuur draagt bij aan de stabiliteit en eigenschappen van de verbinding.
Oplosbaarheid van zilvernitraat
Zilvermononitraat is zeer oplosbaar in water. Het lost gemakkelijk op in water en vormt een heldere, kleurloze oplossing. De oplosbaarheid van zilvermononitraat in water is een essentieel kenmerk en speelt een cruciale rol bij verschillende toepassingen, zoals in de geneeskunde, fotografie en chemische reacties.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 4,35 g/ml |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 169,87 g/mol |
| Dikte | 4,35 g/ml |
| Fusie punt | 209°C (408°F) |
| Kookpunt | 440°C (824°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in water en organische oplosmiddelen zoals ethanol |
| Dampdruk | 0,26 mmHg bij 25°C (77°F) |
| Dampdichtheid | Niet toepasbaar |
| pKa | – |
| pH | Zuur (ongeveer pH 5-6 in waterige oplossing) |
Veiligheid en gevaren van zilvernitraat
Zilvermononitraat brengt enkele veiligheidsrisico’s met zich mee en voorzichtigheid is geboden bij het hanteren van de verbinding. Het wordt als schadelijk beschouwd als het wordt ingeslikt, ingeademd of als het in contact komt met de huid of ogen. Er moeten beschermende maatregelen zoals handschoenen, een veiligheidsbril en laboratoriumjassen worden gebruikt. Dit kan irritatie, brandwonden en vlekken op de huid en andere oppervlakken veroorzaken. Bij verhitting kunnen giftige stikstofoxiden vrijkomen. Het moet op een koele, droge plaats worden bewaard, uit de buurt van onverenigbare stoffen. Gemorste vloeistoffen moeten onmiddellijk worden opgeruimd en de afvalverwerking moet de juiste richtlijnen volgen om besmetting van het milieu te voorkomen.
| Gevarensymbolen | Bijtend, oxiderend |
| Beveiligingsbeschrijving | Veroorzaakt ernstige brandwonden en oogletsel. |
| Identificatiegegevens van de Verenigde Naties | UN 1493 (Massief zilvermononitraat) |
| HS-code | 2843.10.00 |
| Gevarenklasse | Klasse 5.1 (Oxiderende materialen) |
| Verpakkingsgroep | GE II (gemiddeld) |
| Toxiciteit | Giftig voor in het water levende organismen, met langdurige gevolgen. |
Zilvernitraatsynthesemethoden
Er zijn verschillende methoden om zilvermononitraat te synthetiseren.
Een gebruikelijke methode is de reactie tussen metallisch zilver en salpeterzuur . In dit proces lost verdund salpeterzuur zilver op om zilvermononitraat te produceren. Een andere methode omvat de reactie van zilveroxide of zilvercarbonaat met salpeterzuur, resulterend in de vorming van zilvermononitraat.
Bovendien kan de reactie tussen zilverchloride en salpeterzuur ook zilvermononitraat produceren. Salpeterzuur lost zilverchloride op, verdringt de chloride-ionen en vormt zilvermononitraat.
Bovendien maakt de reactie van zilversulfaat met een oplosbaar nitraatzout, zoals natriumnitraat, de verkrijging van zilvermononitraat mogelijk. Zilversulfaat reageert met nitraatzout in een waterige oplossing, wat leidt tot de vorming van zilvermononitraat en een oplosbaar sulfaatzout.
Bij het implementeren van deze synthetische methoden is het belangrijk om passende veiligheidsmaatregelen te nemen en bijtende zuren en potentieel giftige verbindingen te gebruiken. Laboratoriumprotocollen en richtlijnen moeten ook worden gevolgd om een nauwkeurige bereiding en verwerking van zilvermononitraat te garanderen.
Gebruik van zilvernitraat
Zilvermononitraat heeft vele toepassingen op verschillende gebieden. Hier zijn enkele veelvoorkomende toepassingen:
- Fotografie: Traditionele zwart-witfotografie maakt gebruik van zilvermononitraat als een lichtgevoelige verbinding die reageert met licht, waardoor zilverdeeltjes worden gevormd en fotografische beelden ontstaan.
- Geneeskunde: Medische toepassingen gebruiken zilvermononitraat vanwege de antiseptische eigenschappen bij wondverzorging. De plaatselijke toepassing voorkomt infecties, stimuleert de genezing en behandelt brandwonden, zweren en andere huidwonden.
- Laboratoriumreagens: Zilvermononitraat dient als een veelzijdig laboratoriumreagens, waardoor verschillende chemische reacties mogelijk zijn en het wordt gebruikt in de analytische chemie om de aanwezigheid van halogeniden en andere verbindingen te detecteren.
- Verzilveren: Bij galvaniseerprocessen wordt zilvermononitraat gebruikt om actief een dunne laag zilver op verschillende oppervlakken af te zetten. Dit gebruik is gebruikelijk voor decoratieve doeleinden en om corrosieweerstand te bieden.
- Kleuring en kleuring: Histologie en microscopie gebruiken zilvermononitraat als kleurstof om de zichtbaarheid van specifieke structuren in biologische monsters actief te verbeteren. De textielindustrie gebruikt het om stoffen te verven.
- Graveren: De corrosieve aard van zilvermononitraat maakt het actieve gebruik ervan mogelijk bij het etsen van patronen op glas en spiegels. Het verwijdert selectief oppervlaktelagen, waardoor complexe patronen ontstaan.
- Scheikundeonderwijs: Onderwijsinstellingen maken actief gebruik van zilvermononitraat om chemische experimenten en demonstraties uit te voeren, vanwege de duidelijke reacties en visuele effecten ervan.
- Zilverkatalysator: Bij sommige chemische reacties fungeert zilvermononitraat actief als katalysator, waardoor de omzetting van reactanten in de gewenste producten wordt vergemakkelijkt.
Vragen:
Vraag: Is AgNO3 oplosbaar in water?
A: Ja, AgNO3 is oplosbaar in water.
Vraag: Wat is AgNO3?
A: AgNO3 is zilvermononitraat, een chemische verbinding bestaande uit zilver, stikstof en zuurstof.
Vraag: Wat zijn de toeschouwerionen in de reactie tussen KCl(aq) en AgNO3(aq)?
A: Bij de reactie tussen KCl(aq) en AgNO3(aq) zijn de toeschouwerionen K+ en NO3-.
Vraag: Welke ionen, indien aanwezig, zijn toeschouwerionen in de reactie AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)?
A: In de reactie AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq) zijn de toeschouwerionen Na+ en NO3-.
Vraag: Hoeveel mol Cu is nodig om te reageren met 5,8 mol AgNO3?
A: De uitgebalanceerde vergelijking is nodig om het aantal mol Cu te bepalen dat nodig is om te reageren met 5,8 mol AgNO3.
Vraag: Welke van de volgende verbindingen zal een neerslag produceren met AgNO3?
A: Verbindingen die Cl-, Br- of I-ionen bevatten, zullen een neerslag met AgNO3 produceren.
Vraag: Is AgNO3 een ionische verbinding?
A: Ja, AgNO3 is een ionische verbinding.
Vraag: Is AgNO3 een sterke elektrolyt?
A: Ja, AgNO3 is een krachtige elektrolyt.
Vraag: Geleidt AgNO3 elektriciteit?
A: Ja, AgNO3 geleidt elektriciteit wanneer het is opgelost in water.
Vraag: Is zilvernitraat een zout?
A: Ja, zilvermononitraat is een zout.
Vraag: Kan ik zilvernitraat kopen?
A: Ja, zilvermononitraat is in de handel verkrijgbaar.
Vraag: Is zilvernitraat een oplossing?
A: Zilvermononitraat kan in vaste vorm of in oplossingsvorm voorkomen, afhankelijk van de toestand ervan.
Vraag: Hoe zilvernitraatvlekken verwijderen?
A: Zilvermononitraatvlekken kunnen worden verwijderd door het aangetaste gebied te behandelen met een mild reductiemiddel, zoals waterstofperoxide of natriumthiosulfaat.
Vraag: Is zilvernitraat oplosbaar in water?
A: Ja, zilvermononitraat is oplosbaar in water.
Vraag: Welk neerslag ontstaat wanneer oplossingen van zilvernitraat en kaliumchromaat worden gemengd?
A: Wanneer oplossingen van zilvermononitraat en kaliumchromaat worden gemengd, wordt een geel neerslag van zilverchromaat (Ag2CrO4) gevormd.
Vraag: Wat is de molaire massa van zilvernitraat?
A: De molaire massa van zilvermononitraat (AgNO3) is ongeveer 169,87 g/mol.
Vraag: Metallisch zilver wordt toegevoegd aan een oplossing van lood(II)nitraat. Wat is de uitgebalanceerde chemische reactie?
A: De gebalanceerde chemische reactie is 2Ag + Pb(NO3)2 → 2AgNO3 + Pb.
