Hydrazoëzuur (HN3) is een zeer vluchtige verbinding. Het is kleurloos en heeft een scherpe geur. Het wordt gebruikt bij chemische reacties en kan giftig en explosief zijn.
| IUPAC-naam | Hydrazoëzuur |
| Moleculaire formule | HN3 |
| CAS-nummer | 7782-79-8 |
| Synoniemen | Azoimide, waterstofazide, azotinezuur, hydrosalpeterzuur, triazoëzuur |
| InChi | InChI=1S/HN3/c1-3-2/h1H |
Eigenschappen van waterstofzuur
Hydrazoëzuurformule
De chemische formule voor waterstofzuur is HN3. Het bestaat uit één waterstofatoom en drie stikstofatomen die covalent aan elkaar zijn gebonden. Deze eenvoudige formule vertegenwoordigt de basissamenstelling van de verbinding, die cruciaal is voor het begrijpen van de eigenschappen en reacties ervan.
Molaire massa van hydrazoëzuur
De molaire massa van waterstofazide (HN3) is ongeveer 43,03 gram per mol. Deze waarde wordt verkregen door de atoommassa’s van één waterstofatoom (H) en drie stikstofatomen (N) op te tellen. Molaire massa is essentieel voor het berekenen van stoichiometrie bij chemische reacties.
Kookpunt van waterstofzuur
Waterstofazide heeft een relatief laag kookpunt, ongeveer 37 graden Celsius (98,6 graden Fahrenheit). Vanwege zijn vluchtige aard verdampt het bij gematigde temperaturen gemakkelijk in gasvorm. Uiterste voorzichtigheid is geboden bij het hanteren van deze verbinding.
Hydrazoëzuur Smeltpunt
Het smeltpunt van waterstofazide ligt rond -80 graden Celsius (-112 graden Fahrenheit). Bij deze temperatuur verandert de vaste verbinding in een vloeibare vorm. Omdat het zeer reactief is, vereist de vaste toestand ervan een juiste opslag en hantering.
Dichtheid van hydrazoëzuur g/ml
De dichtheid van waterstofazide is ongeveer 1,09 gram per milliliter. Deze waarde geeft de massa per volume-eenheid aan en weerspiegelt de compactheid en concentratie in een bepaalde ruimte. Het is een kritische parameter voor laboratoriummetingen.
Hydrazoëzuur Molecuulgewicht
Het molecuulgewicht van waterstofazide (HN3) is 43,03 gram per mol. Het is de som van de atoomgewichten van de elementen die aanwezig zijn in een enkel molecuul van de verbinding. Het molecuulgewicht speelt een cruciale rol bij het bepalen van het fysische en chemische gedrag ervan.
Structuur van waterstofzuur
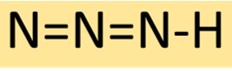
Waterstofazide heeft een lineaire moleculaire structuur, bestaande uit drie stikstofatomen die opeenvolgend zijn gebonden met aan het uiteinde een enkel waterstofatoom. Deze opstelling resulteert in een stabiele maar zeer reactieve verbinding, die vaak wordt gebruikt bij chemische synthese.
Oplosbaarheid van waterstofzuur
Waterstofazide heeft een beperkte oplosbaarheid in water, waardoor het een slecht oplosbare verbinding is. Het kan in kleine mate oplossen in waterige oplossingen, maar de lage oplosbaarheid beperkt het gebruik ervan in sommige toepassingen. Speciale zorg is nodig bij de omgang met de waterige vorm vanwege de giftige en explosieve aard ervan.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 1,09 g/ml |
| Kleur | Kleurloos |
| Geur | Scherpe geur |
| Molaire massa | 43,03 g/mol |
| Dikte | 1,09 g/ml |
| Fusie punt | -80°C (-112°F) |
| Kookpunt | 37°C (98,6°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Enigszins oplosbaar |
| Oplosbaarheid | Oplosbaar in alkalische en organische oplosmiddelen zoals alcohol, ether |
| Dampdruk | 23,1 mmHg bij 20°C |
| Dampdichtheid | 1,4 (lucht = 1) |
| pKa | 4.6 |
| pH | Ongeveer 3-4 |
Veiligheid en gevaren van hydrazoëzuur
Waterstofazide brengt aanzienlijke veiligheidsrisico’s met zich mee. Het is zeer giftig en kan bij blootstelling ernstige gevolgen voor de gezondheid veroorzaken. Inademing van de dampen of nevels kan irritatie van de luchtwegen, duizeligheid en zelfs de dood veroorzaken. Contact met de huid of ogen kan brandwonden, irritatie en weefselschade veroorzaken. De verbinding is ook uiterst brandbaar en kan explosieve mengsels vormen. Het reageert heftig met verschillende stoffen, zoals metalen en oxidatiemiddelen. Bij het hanteren van waterstofazide moeten passende veiligheidsmaatregelen worden gevolgd, waaronder het dragen van beschermende kleding, het gebruik van voldoende ventilatie en het veilig opslaan ervan om ongelukken of lozingen in het milieu te voorkomen. de omgeving.
| Gevarensymbolen | Schedel met gekruiste knekels, bijtend |
| Beveiligingsbeschrijving | Zeer giftig, bijtend |
| VN-identificatienummers | VN1687 |
| HS-code | 2811.29.10 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | II (Gemiddeld gevaar) |
| Toxiciteit | Zeer giftig; kan in kleine hoeveelheden dodelijk zijn |
Methoden voor de synthese van waterstofzuur
Verschillende methoden maken de synthese van waterstofazide mogelijk.
Een gebruikelijke aanpak betreft de reactie tussen natriumazide (NaN3) en een zuur, zoals zwavelzuur (H2SO4) of zoutzuur (HCl) . Bij deze methode mengt het zuur zich met natriumazide, waardoor waterstofazide en het overeenkomstige zout van het gebruikte zuur ontstaan.
Een andere methode omvat de reactie tussen natriumazide en een alkylhalogenide, zoals methyljodide (CH3I) of ethyljodide (C2H5I). Deze reactie, bekend als de Curtius-omlegging, resulteert in de vorming van waterstofazide als product.
Bij de reactie tussen natriumazide en salpeterigzuur (HNO2) ontstaat waterstofazide. Om in situ salpeterigzuur te genereren, wordt doorgaans natriumnitriet (NaNO2) aan een zure oplossing toegevoegd. De reactie tussen natriumazide en salpeterigzuur produceert waterstofazide.
Het is belangrijk op te merken dat de synthese van waterstofazide een zorgvuldige omgang en passende veiligheidsmaatregelen vereist. Vanwege de toxiciteit en het explosieve karakter ervan moeten reacties worden uitgevoerd in een goed geventileerde ruimte, met gebruikmaking van geschikte beschermende uitrusting en volgens vastgestelde protocollen.
Elke synthesemethode heeft zijn voordelen en beperkingen, en de keuze van de methode hangt af van factoren zoals de beschikbaarheid van reagentia, de gewenste opbrengst en veiligheidsoverwegingen. Een goed begrip en expertise in de omgang met gevaarlijke chemicaliën is essentieel om deze syntheses efficiënt en veilig uit te voeren.
Gebruik van hydrazoëzuur
Waterstofazide vindt vanwege zijn unieke eigenschappen toepassingen op verschillende gebieden. Hier zijn enkele toepassingen:
- Chemisch reagens: Waterstofazide dient als een veelzijdig chemisch reagens bij de organische synthese en neemt actief deel aan vele reacties, waaronder de synthese van aziden, die cruciale bouwstenen zijn in farmaceutische producten en kleurstoffen.
- Ontstekers en drijfgassen: Fabrikanten gebruiken waterstofazide voor de productie van ontstekers en drijfgassen die worden gebruikt in airbags en veiligheidsvoorzieningen, waarbij ze profiteren van het explosieve karakter en de snelle ontbinding ervan, waardoor actief stikstofgas vrijkomt, wat het waardevol maakt in deze toepassingen.
- Laboratoriumanalyse: Analytische chemie maakt gebruik van waterstofazide voor de actieve detectie en bepaling van verschillende elementen en verbindingen. Het vormt actief complexen met specifieke metalen, waardoor hun kwantificering door colorimetrische of titratiemethoden mogelijk wordt.
- Biochemisch onderzoek: Bij biochemisch onderzoek gebruiken wetenschappers actief waterstofazide om biomoleculen te modificeren en hun functies te bestuderen. Het reageert selectief met bepaalde functionele groepen en draagt zo actief bij aan de identificatie en karakterisering van biologische moleculen.
- Fotografie: In traditionele zwart-witfotografie functioneert waterstofazide actief als sensibilisator in emulsies, waardoor de lichtgevoeligheid van fotografische films wordt verbeterd en actief wordt geleid tot een betere beeldkwaliteit.
- Corrosieremmer: Industrieën gebruiken actief waterstofazide als corrosieremmer voor metalen, vooral koper en zijn legeringen. Het vormt actief een beschermende laag op het metalen oppervlak, voorkomt actief corrosie en verlengt de levensduur van verschillende apparatuur en constructies.
- Gasgeneratoren: Waterstofazide speelt actief een rol in gasgeneratoren voor airbags en reddingssystemen. Door de snelle ontbinding komt actief stikstofgas vrij, waardoor de kracht ontstaat die nodig is voor het opblazen en ontplooien.
Vragen:
Vraag: Is hydrazoëzuur bijtend?
A: Ja, hydrazoëzuur wordt als bijtend beschouwd en kan bij contact brandwonden en weefselschade veroorzaken.
Vraag: Is hydrazoëzuur een sterk zuur?
A: Ja, hydrazoëzuur is geclassificeerd als een sterk zuur dat in water volledig kan ioniseren, waardoor hydroniumionen vrijkomen.
Vraag: Is hydrazoëzuur een ternair zuur?
A: Nee, hydrazoëzuur is geen ternair zuur. Ternaire zuren bevatten drie verschillende elementen (waterstof, zuurstof en een derde element), terwijl waterstofzuur alleen waterstof, stikstof en zuurstof bevat.
Vraag: Hoeveel ml waterstofzuur per 12,5 ml?
A: De vraag lijkt onvolledig en vereist aanvullende informatie voor een juist antwoord.
Vraag: Wat is de juiste Lewis-structuur voor waterstofzuur (HN3), inclusief eventuele formele ladingen?
A: De juiste Lewis-structuur voor HN3 bestaat uit een centraal stikstofatoom gebonden aan drie andere stikstofatomen en één waterstofatoom. Formele ladingen kunnen worden bepaald op basis van verschillen in elektronegativiteit.
Vraag: Hoe beïnvloedt hydrozoëzuur cytochroom c-oxidase?
A: Waterstofazide remt cytochroom-c-oxidase, een enzym dat betrokken is bij cellulaire ademhaling, door zich te binden aan de actieve plaats en de functie ervan te verstoren.
Vraag: Wat is de Ka van waterstofzuur als 0,20 M waterstofzuur een pH van 3,21 heeft?
A: De Ka van waterstofzuur kan worden berekend met behulp van de pH en de vergelijking Ka = [H3O+][A-]/[HA]. Om de Ka-waarde te bepalen is meer informatie nodig.
Vraag: Wat is de oxidatietoestand van stikstof in waterstofzuur (HN3)?
A: De oxidatietoestand van stikstof in waterstofzuur is -1.
Vraag: Wat is de pH van een 0,15 molaire oplossing van HN3 als Ka = 1,8 × 10^-9?
A: De pH van een 0,15 molaire oplossing van HN3 kan worden berekend met behulp van de Ka-waarde en de vergelijking pH = -log10(sqrt(Ka × [HA])).
Vraag: Hoe kan ik N2 + H2 in HN3 balanceren?
A: De uitgebalanceerde vergelijking voor de reactie N2 + H2 → HN3 zou 3N2 + 6H2 → 2HN3 zijn.
Vraag: Hoe bereken je de Ka van HN3?
A: De Ka van HN3 kan worden berekend met behulp van de evenwichtsconcentratie van de producten en reactanten in de HN3-dissociatiereactie.
Vraag: Wat is de molariteit van NaN3 als de molariteit van HN3 0,012 M is?
A: De molariteit van NaN3 kan niet worden bepaald zonder aanvullende informatie of de uitgebalanceerde vergelijking voor de reactie tussen NaN3 en HN3.
Vraag: Wat is de juiste Lewis-structuur voor waterstofzuur (HN3), inclusief eventuele formele ladingen?
A: De juiste Lewis-structuur voor HN3 omvat een centraal stikstofatoom gebonden aan drie andere stikstofatomen en één waterstofatoom. Formele ladingen kunnen worden bepaald op basis van verschillen in elektronegativiteit.
