Trinatriumfosfaat (Na3PO4) is een verbinding bestaande uit natrium- en fosfaationen. Het heeft verschillende toepassingen in industrieën zoals de voeding, de farmaceutische industrie en wasmiddelen, vanwege zijn vermogen om de zuurgraad onder controle te houden en als buffer te fungeren.
| IUPAC-naam | Trinatrium fosfaat |
| Moleculaire formule | Na3PO4 |
| CAS-nummer | 7601-54-9 |
| Synoniemen | natriumfosfaat, TSP, natriumorthofosfaat, tribasisch natriumfosfaat, tertiair natriumfosfaat, trinatriumorthofosfaat |
| InChi | InChI=1S/3Na.H3O4P/c;;;1-5(2,3)4/h;;;(H3,1,2,3,4)/q3*+1;/p-3 |
Eigenschappen van trinatriumfosfaat
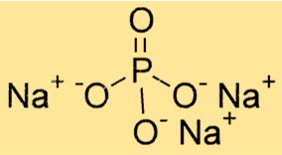
Trinatriumfosfaatformule
De chemische formule voor trinatriumfosfaat is Na3PO4. Het bestaat uit drie natriumkationen (Na+) en één fosfaatanion (PO43-). De formule is belangrijk voor het bepalen van de stoichiometrie van chemische reacties en voor het berekenen van de hoeveelheid van een stof in een bepaalde hoeveelheid.
Trinatriumfosfaat molaire massa
De molmassa van Na3PO4 bedraagt 163,94 g/mol. Het wordt berekend door de atoommassa’s van de samenstellende elementen, namelijk natrium, fosfor en zuurstof, bij elkaar op te tellen. Molaire massa is een belangrijke parameter die wordt gebruikt om te bepalen hoeveel van een stof zich in een bepaalde hoeveelheid bevindt. Het wordt ook gebruikt om de stoichiometrie van chemische reacties te berekenen.
Trinatriumfosfaat Kookpunt
Het kookpunt van Na3PO4 is 1587°C. Dit is de temperatuur waarbij de vloeibare toestand overgaat in de gasvormige toestand. Het kookpunt van een stof hangt af van verschillende factoren, zoals druk, temperatuur en intermoleculaire krachten. Het hoge kookpunt van Na3PO4 is te wijten aan zijn ionische aard en sterke intermoleculaire krachten.
Smeltpunt van trinatriumfosfaat
Het smeltpunt van Na3PO4 is 1340°C. Dit is de temperatuur waarbij een vaste stof overgaat in een vloeibare toestand. Het smeltpunt van een stof hangt af van verschillende factoren, zoals druk, temperatuur en intermoleculaire krachten. Het hoge smeltpunt van Na3PO4 is te danken aan zijn ionische aard en sterke intermoleculaire krachten.
Trinatriumfosfaat Dichtheid g/ml
De dichtheid van Na3PO4 bedraagt 2,54 g/ml. Dichtheid is de maat voor de massa van een stof per volume-eenheid. Het is een belangrijke fysieke eigenschap van een stof die wordt gebruikt om de massa of het volume ervan te bepalen. De hoge dichtheid van Na3PO4 is te danken aan de ionische aard en de dicht opeengepakte deeltjes.
Trinatriumfosfaat Molecuulgewicht
Het molecuulgewicht van Na3PO4 bedraagt 163,94 g/mol. Het is de som van de atoomgewichten van alle atomen in een molecuul. Het molecuulgewicht van Na3PO4 is belangrijk voor het bepalen van de stoichiometrie van chemische reacties en voor het berekenen van de hoeveelheid van een stof in een bepaalde hoeveelheid.
Structuur van trinatriumfosfaat
Na3PO4 heeft een kristalstructuur met een hexagonale opstelling van dicht opeengepakte atomen. Natriumkationen bevinden zich in de tussenruimten van compacte zuurstofanionen. Het fosfaatanion bestaat uit één fosforatoom en vier zuurstofatomen, gerangschikt in een tetraëdrische vorm.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 2.536 g/cm3 |
| Kleur | Kleurloos tot wit |
| Geur | Geurloos |
| Molaire massa | 163,94 g/mol |
| Dikte | 2,54 g/ml |
| Fusie punt | 1340°C |
| Kookpunt | 1.587°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water en onoplosbaar in organische oplosmiddelen |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | pKa1 = 2,15, pKa2 = 7,20, pKa3 = 12,35 |
| pH | pH van 0,1 M oplossing = 11,5 |
Veiligheid en gevaren van trinatriumfosfaat
Na3PO4 wordt over het algemeen als veilig beschouwd voor gebruik in voedingsmiddelen, farmaceutische producten en andere toepassingen. Zoals elke chemische stof kan het echter gevaren opleveren als het verkeerd wordt gebruikt. Het innemen van grote hoeveelheden Na3PO4 kan leiden tot maag-darmproblemen zoals diarree, misselijkheid en braken. Oog- en huidcontact met de stof kan irritatie en brandwonden veroorzaken. Het is belangrijk om voorzichtig om te gaan met Na3PO4, geschikte persoonlijke beschermingsmiddelen te dragen en alle veiligheidsprocedures te volgen wanneer u met deze stof werkt. In geval van inslikken of accidentele blootstelling, dient u onmiddellijk medische hulp in te roepen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Gebruiken met voldoende ventilatie. Vermijd contact met huid en ogen. Draag beschermende uitrusting. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 28352200 |
| Gevarenklasse | Niet geclassificeerd als gevaarlijk |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit. Inslikken van grote hoeveelheden kan maag-darmproblemen veroorzaken. Kan irritatie en brandwonden veroorzaken bij contact met de huid en ogen. |
Methoden voor de synthese van trinatriumfosfaat
Er zijn verschillende methoden voor het synthetiseren van Na3PO4, waaronder de reactie van natriumhydroxide met fosforzuur , de reactie van natriumcarbonaat met fosforzuur en de reactie van natriumchloride met fosforzuur in aanwezigheid van natriumcarbonaat.
Een gebruikelijke methode omvat de reactie van natriumhydroxide (NaOH) met fosforzuur (H3PO4) . Bij deze reactie ontstaat Na3PO4 (Na3PO4) en water (H2O). De uitgebalanceerde chemische vergelijking voor deze reactie is:
3 NaOH + H3PO4 → Na3PO4 + 3 H2O
Een andere methode omvat de reactie van natriumcarbonaat (Na2CO3) met fosforzuur (H3PO4) . Bij deze reactie ontstaan Na3PO4 (Na3PO4), kooldioxide (CO2) en water (H2O). De uitgebalanceerde chemische vergelijking voor deze reactie is:
Na2CO3 + 2 H3PO4 → 2 Na3PO4 + 3 CO2 + 3 H2O
Een derde methode omvat de reactie van natriumchloride (NaCl) met fosforzuur (H3PO4) in aanwezigheid van natriumcarbonaat (Na2CO3) . Bij deze reactie ontstaan Na3PO4 (Na3PO4), natriumchloride (NaCl), kooldioxide (CO2) en water (H2O). De uitgebalanceerde chemische vergelijking voor deze reactie is:
3 NaCl + H3PO4 + Na2CO3 → Na3PO4 + 3 NaCl + 3 CO2 + 3 H2O
Industrieën gebruiken deze methoden op grote schaal om Na3PO4 voor verschillende toepassingen te produceren.
Gebruik van trinatriumfosfaat
Na3PO4 heeft vanwege zijn unieke eigenschappen vele toepassingen in verschillende industrieën. Enkele veel voorkomende toepassingen van Na3PO4 zijn:
- Voedingsindustrie: Gebruikt als voedingsadditief om de textuur, smaak en houdbaarheid van bewerkte voedingsproducten te verbeteren.
- Farmaceutische industrie: gebruikt bij de productie van verschillende farmaceutische producten, waaronder laxeermiddelen, maagzuurremmers en elektrolytoplossingen.
- Waterbehandeling: Gebruikt in waterbehandelingsprocessen om kalkvorming te beheersen en corrosie in waterdistributiesystemen te voorkomen.
- Wasmiddelenindustrie: Gebruikt bij de productie van wasmiddelen om hun reinigende eigenschappen te verbeteren.
- Landbouw: Gebruikt als meststof en bodemverbeteraar in de landbouw om essentiële voedingsstoffen aan planten te leveren.
- Industriële toepassingen: Gebruikt in diverse industriële processen, waaronder de behandeling van metalen oppervlakken, de productie van keramiek en als vlamvertrager.
- Laboratoriumtoepassingen: Gebruikt in diverse laboratoriumtoepassingen, waaronder DNA- en eiwitzuivering, bufferoplossingen en als pH-regulator.
Vragen:
Vraag: Is Na3PO4 oplosbaar in water?
A: Ja, Na3PO4 is zeer oplosbaar in water.
Vraag: Wat is de molaire concentratie natriumionen in een 0,350 M Na3PO4-oplossing?
A: In een 0,350 M Na3PO4-oplossing is de molaire concentratie natriumionen 1,05 M.
Vraag: Is Na3PO4 een zuur of een base?
A: Na3PO4 is een basisch zout.
Vraag: Wat is de netto ionische vergelijking voor de reactie tussen waterige oplossingen van Na3PO4 en CuSO4?
A: De netto ionische vergelijking voor de reactie tussen waterige oplossingen van Na3PO4 en CuSO4 is: 2Na+(aq) + Cu2+(aq) + 2PO43-(aq) + SO42-(aq) → Cu3(PO4)2(s) + 2Na+ (aq) + SO42-(aq).
Vraag: Welk volume van een 3,50 M Na3PO4-oplossing moet u gebruiken om 1,50 L van een 2,55 M Na3PO4-oplossing te bereiden?
A: Om een 2,55 M Na3PO4-oplossing te bereiden met behulp van een 3,50 M Na3PO4-oplossing, heeft u 0,921 L van de 3,50 M-oplossing nodig.
Vraag: Wat is trinatriumfosfaat?
A: Trinatriumfosfaat is een anorganisch natriumfosfaatzout met de chemische formule Na3PO4.
Vraag: Is trinatriumfosfaat oplosbaar?
A: Ja, trinatriumfosfaat is zeer oplosbaar in water.
Vraag: Hoe weet u of een wit poeder dat u heeft natriumbicarbonaat of trinatriumfosfaat is?
A: Eén manier om natriumbicarbonaat te onderscheiden van Na3PO4 is door een eenvoudige pH-test uit te voeren. Natriumbicarbonaat is basisch en geeft een pH boven de 7, terwijl Na3PO4 neutraal is en een pH van 7 oplevert.
Vraag: Wat is de formule voor trinatriumfosfaat?
A: De formule voor trinatriumfosfaat is Na3PO4.
