Thionylchloride is een chemische verbinding die in verschillende industriële toepassingen wordt gebruikt. Het reageert met alcoholen en carbonzuren en produceert respectievelijk de overeenkomstige chloriden en sulfidechloride.
| Naam van IUPAC | Thionylchloride |
| Moleculaire formule | SOCl₂ |
| CAS-nummer | 7719-09-7 |
| Synoniemen | Zwaveldichloride, Zwaveloxychloride, Thionyldichloride |
| InChi | InChI=1S/Cl2OS/c1-4(2)3 |
Eigenschappen van thionylchloride
Thionylchloride-formule
De formule voor thionyldichloride is SOCl₂, wat staat voor één zwavelatoom gebonden aan twee chlooratomen. Het is een chemische verbinding die veel wordt gebruikt in verschillende industrieën.
Thionylchloride molaire massa
Thionyldichloride heeft een molaire massa van ongeveer 118,97 gram per mol. De molaire massa wordt bepaald door de atoommassa’s van de samenstellende elementen op te tellen.
Kookpunt van thionylchloride
Thionyldichloride heeft een kookpunt van ongeveer 79,6 graden Celsius. Dit is de temperatuur waarbij de vloeibare vorm van thionyldichloride overgaat in de gasvormige toestand.
Smeltpunt van thionylchloride
Het smeltpunt van thionyldichloride is ongeveer -104,5 graden Celsius. Dit is de temperatuur waarbij de vaste vorm van thionyldichloride overgaat in de vloeibare toestand.
Dichtheid van thionylchloride g/ml
Thionyldichloride heeft een dichtheid van ongeveer 1,64 gram per milliliter. Dichtheid is de maatstaf voor massa per volume-eenheid en is een belangrijk kenmerk van een stof.
Thionylchloride Molecuulgewicht
Het molecuulgewicht van thionyldichloride is ongeveer 118,97 gram per mol. Het wordt berekend door de atoomgewichten van zwavel, chloor en zuurstof op te tellen.
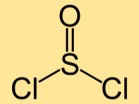
Structuur van thionylchloride
De structuur van thionyldichloride bestaat uit een zwavelatoom gebonden aan twee chlooratomen. De zwavel- en chlooratomen zijn lineair gerangschikt en vormen een gebogen molecuul.
Oplosbaarheid van thionylchloride
Thionyldichloride is slecht oplosbaar in water, maar lost gemakkelijk op in organische oplosmiddelen zoals benzeen, tolueen en tetrachloorkoolstof. De oplosbaarheid is een belangrijke factor bij de toepassingen ervan.
| Verschijning | Kleurloze tot lichtgele vloeistof |
| Soortelijk gewicht | 1.638 g/ml |
| Kleur | Kleurloos |
| Geur | Scherp, verstikkend |
| Molaire massa | 118,97 g/mol |
| Dikte | 1.638 g/ml |
| Fusie punt | -104,5°C |
| Kookpunt | 79,6°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Reageert heftig |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals benzeen, tolueen en tetrachloorkoolstof |
| Dampdruk | 4,33 kPa bij 20°C |
| Dampdichtheid | 3,9 (lucht = 1) |
| pKa | -6,3 |
| pH | Niet toepasbaar |
Veiligheid en gevaren van thionylchloride
Thionyldichloride brengt verschillende veiligheidsrisico’s met zich mee en moet met zorg worden behandeld. Het is zeer bijtend en kan ernstige brandwonden veroorzaken bij contact met de huid, ogen of slijmvliezen. Inademing van de dampen kan irritatie en ademhalingsschade veroorzaken. De verbinding reageert heftig met water, waarbij giftige gassen vrijkomen, zoals waterstofchloride. Het moet daarom uit de buurt van vochtbronnen worden opgeslagen en gehanteerd. Thionyldichloride reageert ook krachtig met alcoholen en waterhoudende verbindingen, wat kan leiden tot brand- of explosiegevaar. Adequate ventilatie, persoonlijke beschermingsmiddelen en goede opslagpraktijken zijn essentieel om een veilige omgang met thionyldichloride te garanderen.
| Gevarensymbolen | Bijtend (C), giftig (T), gevaarlijk voor het milieu (N) |
| Beveiligingsbeschrijving | – Uit de buurt houden van vochtbronnen en onverenigbare stoffen.<br>- Gebruiken in een goed geventileerde ruimte en geschikte persoonlijke beschermingsmiddelen dragen.<br>- Wees voorzichtig om contact met de huid, ogen en slijmvliezen te vermijden.<br> – Bewaren in een goed gesloten verpakking op een koele, droge plaats. |
| VN-identificatienummers | UN-nr. 1836 (thionyldichloride) |
| HS-code | 2812.10.00 |
| Gevarenklasse | 8 (Bijtende stoffen) |
| Verpakkingsgroep | II (Redelijk gevaarlijk) |
| Toxiciteit | Zeer giftig bij inademing, inslikken en huidopname.<br>- Kan ernstige brandwonden en irritatie van de luchtwegen veroorzaken.<br>- Kan op lange termijn schadelijke effecten op in het water levende organismen veroorzaken. |
Methoden voor de synthese van thionylchloride
Verschillende methoden maken de synthese van thionyldichloride mogelijk.
Een gebruikelijke aanpak omvat de reactie tussen zwaveltrioxide (SO₃) en zwaveldichloride (SCl₂) in aanwezigheid van een katalysator zoals actieve kool of aluminiumchloride . De reactie vindt plaats bij hoge temperaturen, gewoonlijk rond de 300 tot 400 °C, en produceert zo thionyldichloride.
Een andere methode is de directe reactie van zwaveldioxide (SO₂) met fosforpentachloride (PCl₅) of fosforoxychloride (POCl3). Deze reactie vindt plaats onder terugvloeiing, met geleidelijke toevoeging van de reagentia, en leidt tot thionyldichloride.
Door de reactie van zwavel met fosfortrichloride (PCl3) ontstaat thionyldichloride. Dit proces omvat het verwarmen van de reactanten en het mogelijk maken van de vorming van thionyldichloride.
Een andere methode omvat de reactie tussen fosforpentasulfide (P2S5) en fosforpentachloride (PC15) in aanwezigheid van een Lewis-zuurkatalysator zoals aluminiumchloride. De reactie vindt plaats bij hoge temperaturen en resulteert in de vorming van thionyldichloride.
Het is belangrijk op te merken dat deze synthesemethoden een juiste hantering en veiligheidsmaatregelen vereisen vanwege de gevaarlijke aard van de betrokken reagentia. De veilige en efficiënte synthese van thionyldichloride vereist de expertise van ervaren chemici en het gebruik van geschikte laboratoriumapparatuur.
Gebruik van thionylchloride
Thionyldichloride vindt brede toepassingen in verschillende industrieën vanwege zijn veelzijdige chemische eigenschappen. Hier zijn enkele veelvoorkomende toepassingen van thionyldichloride:
- Omzetting van carboxylzuren: Thionyldichloride zet carbonzuren om in acylchloriden, grotendeels met behulp van de Vilsmeier-Haack-reactie bij de organische synthese.
- Alcoholchlorering: Thionyldichloride reageert met alcoholen, vormt alkylchloriden en vindt toepassing bij de productie van gechloreerde verbindingen voor farmaceutische producten en landbouwchemicaliën, bekend als de Darzens-reactie.
- Dehydraterend middel: Thionyldichloride werkt als een dehydraterend middel en vergemakkelijkt de verwijdering van verschillende verbindingen uit water. Het wordt vaak gebruikt bij de synthese van kleurstoffen, parfums en farmaceutische tussenproducten.
- Productie van lithium-ionbatterijen: Fabrikanten gebruiken thionyldichloride om lithium-thionyldichloridebatterijen te produceren, die een hoge energiedichtheid en een lange houdbaarheid hebben. Deze batterijen worden toegepast in medische apparaten, militaire uitrusting en afstandssensoren.
- Polymerisatiereacties: Thionyldichloride neemt deel aan polymerisatiereacties en draagt bij aan de synthese van verschillende polymeren, waaronder polycarbonaten en polyanhydriden.
- Fosforverbindingen: Thionyldichloride reageert met fosforverbindingen, zoals fosfortrichloride, waarbij fosforylchloriden worden geproduceerd. Chemici gebruiken deze tussenproducten om organofosfaatverbindingen en vlamvertragers te synthetiseren.
- Chemisch reagens: Thionyldichloride dient als een veelzijdig reagens bij veel chemische transformaties, waaronder verestering, halogenering en nucleofiele substitutiereacties.
Vragen:
Vraag: Waarmee kunt u thionylchloride spoelen?
A: Thionyldichloride kan worden gespoeld met een grote overmaat alcohol of een compatibele base, zoals methanol of natriumbicarbonaatoplossing.
Vraag: Wat is het product van valeriaanzuur met thionylchloride?
A: De reactie van valeriaanzuur met thionyldichloride produceert valerilchloride, evenals zwaveldioxidegas.
Vraag: Kun je thionylchloride toevoegen met een carbonzuur?
A: Ja, thionyldichloride kan aan een carbonzuur worden toegevoegd om het door de Vilsmeier-Haack-reactie om te zetten in acylchloride.
Vraag: Welke van de volgende is de juiste Lewis-formule voor thionylchloride (SOCl2)?
A: De juiste Lewis-formule voor thionyldichloride (SOCl2) wordt weergegeven door S=O | Cl – Cl.
Vraag: Wat drijft de thionylchloridereactie aan?
A: De thionyldichloridereactie wordt aangedreven door de hoge reactiviteit van thionylchloride, dat als elektrofiel fungeert bij verschillende chemische transformaties.
Vraag: Hoe thionylchloride te blussen?
A: Thionyldichloride kan worden geblust door een geschikt blusmiddel toe te voegen, zoals een primaire of secundaire alcohol, of door het zorgvuldig te hydrolyseren met water.
Vraag: Wat zou je krijgen als je aminen mengt met thionylchloride?
A: Het mengen van aminen met thionyldichloride resulteert in de vorming van overeenkomstige aminehydrochloridezouten.
Vraag: Wat is thionylchloride?
A: Thionyldichloride is een chemische verbinding met de formule SOCl2, die gewoonlijk wordt gebruikt als reagens bij organische synthese en als dehydraterend middel.
Vraag: Wat zal overtollig thionylchloride doen?
A: Overmatig thionyldichloride kan heftige reacties veroorzaken, mogelijk resulterend in de productie van giftige gassen of explosiegevaar, en moet met voorzichtigheid worden gehanteerd.
Vraag: Hoe thionylchloride neutraliseren?
A: Thionyldichloride kan worden geneutraliseerd door het voorzichtig toe te voegen aan een grote overmaat van een geschikte base, zoals natriumbicarbonaat of natriumhydroxide, terwijl de juiste veiligheidsmaatregelen worden genomen.
