Tetrafluorethyleen of C2F4 is een kleurloos en geurloos gas dat wordt gebruikt bij de productie van fluorpolymeren zoals Teflon. Het wordt ook gebruikt bij de productie van koelmiddelen en drijfgassen.
| Naam van IUPAC | Tetrafluorethyleen |
| Moleculaire formule | C2F4 |
| CAS-nummer | 116-14-3 |
| Synoniemen | TFE, perfluorethyleen, etheen, tetrafluor-, F4E, freon 1113, halokoolstof 1113 |
| InChi | InChI=1S/C2F4/c3-1(4)2(5)6 |
Lewis-structuur C2F4
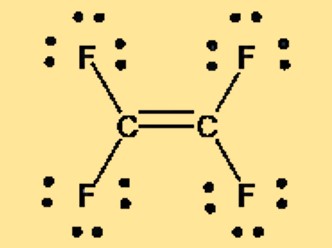
De Lewis-structuur van tetrafluorethyleen, ook bekend als TFE of C2F4, kan worden weergegeven door twee koolstofatomen die dubbel aan elkaar gebonden zijn, waarbij elk koolstofatoom gebonden is aan twee fluoratomen. De Lewis-structuur toont de rangschikking van valentie-elektronen in het molecuul en geeft informatie over de binding en geometrie van het molecuul. De niet-polaire aard van TFE blijkt ook uit de Lewis-structuur, die geen ladingsscheiding of netto dipoolmoment vertoont.
Molaire massa van tetrafluorethyleen
De molaire massa van tetrafluorethyleen, ook wel TFE of C2F4 genoemd, is 100,02 g/mol. Deze waarde wordt berekend door de atoommassa’s van alle elementen in het molecuul op te tellen, namelijk twee koolstofatomen en vier fluoratomen. Molaire massa is een belangrijke parameter bij het bepalen van de hoeveelheid van een stof die aanwezig is in een bepaald volume of een bepaalde massa en wordt ook gebruikt bij stoichiometrische berekeningen.
Kookpunt van tetrafluorethyleen
Tetrafluorethyleen heeft een kookpunt van -76,3°C (-105,34°F) bij standaarddruk. Het is een zeer vluchtig gas dat snel kan verdampen bij kamertemperatuur en atmosferische druk. Het lage kookpunt van TFE maakt het ideaal voor diverse industriële toepassingen zoals in koelsystemen en als drijfgas voor spuitbussen.
Smeltpunt van tetrafluorethyleen
Tetrafluorethyleen heeft geen duidelijk smeltpunt omdat het rechtstreeks een faseovergang ondergaat van vast naar gas, waarbij de vloeibare fase wordt overgeslagen. De vaste vorm van TFE kan echter voorkomen bij temperaturen lager dan -76,3°C onder hoge drukomstandigheden. De vaste vorm van TFE is ook zeer onstabiel en reactief en kan spontaan polymeriseren of ontleden.
Dichtheid van tetrafluorethyleen g/ml
De dichtheid van tetrafluorethyleen bij standaardtemperatuur en druk (STP) is 1,47 g/l. Omdat TFE echter een gas is, kan de dichtheid ervan aanzienlijk variëren bij veranderingen in temperatuur en druk. Bij kamertemperatuur en atmosferische druk is de dichtheid van TFE ongeveer 3,21 g/l.
Molecuulgewicht van tetrafluorethyleen
Het molecuulgewicht van C2F4 is 100,02 g/mol. Deze waarde wordt berekend door de atoomgewichten van alle atomen in het molecuul op te tellen. TFE heeft een relatief laag molecuulgewicht, wat bijdraagt aan de hoge vluchtigheid en het lage kookpunt.
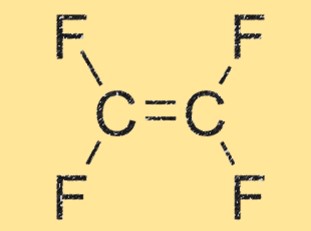
C2F4-structuur
C2F4 heeft een lineaire structuur, waarbij twee koolstofatomen dubbel aan elkaar gebonden zijn en elk gebonden aan twee fluoratomen. Het molecuul is zeer symmetrisch en heeft geen netto dipoolmoment, waardoor het niet-polair is. De lineaire geometrie van TFE draagt ook bij aan de hoge reactiviteit en het vermogen om polymeerketens te vormen.
Formule C2F4
De chemische formule voor C2F4 is C2F4, wat aangeeft dat het molecuul twee koolstofatomen en vier fluoratomen bevat. De formule geeft informatie over de soorten en aantallen atomen die in het molecuul aanwezig zijn, wat nuttig kan zijn bij het voorspellen van het chemische gedrag en de reacties ervan.
| Verschijning | Kleurloos gas |
| Soortelijk gewicht | 1,47 g/l bij STP |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 100,02 g/mol |
| Dikte | 3,21 g/l bij kamertemperatuur en atmosferische druk |
| Fusie punt | Heeft geen duidelijk smeltpunt |
| Kookpunt | -76,3°C (-105,34°F) bij standaarddruk |
| Flitspunt | Niet van toepassing omdat TFE een gas is |
| oplosbaarheid in water | Onoplosbaar |
| Oplosbaarheid | Oplosbaar in sommige organische oplosmiddelen zoals aceton en chloroform |
| Dampdruk | 209,7 kPa bij 20°C |
| Dampdichtheid | 2,95 (lucht = 1) |
| pKa | Niet van toepassing, aangezien TFE noch een zuur, noch een base is |
| pH | Niet van toepassing, aangezien TFE noch een zuur, noch een base is |
Veiligheid en gevaren van tetrafluorethyleen
Tetrafluorethyleen kan verschillende veiligheids- en gezondheidsrisico’s met zich meebrengen als het niet op de juiste manier wordt behandeld. Blootstelling aan hoge concentraties TFE kan irritatie aan de ogen, huid en luchtwegen veroorzaken. Langdurige blootstelling kan ook leiden tot longschade, waaronder longoedeem en longontsteking. TFE is eveneens een brandbaar gas dat met lucht explosieve mengsels kan vormen. Daarom moet het worden opgeslagen en vervoerd in gespecialiseerde containers om het risico op brand of explosie te voorkomen. Het is belangrijk om geschikte beschermende uitrusting te gebruiken, inclusief ademhalingsbescherming, bij het hanteren van TFE om blootstelling te voorkomen en het risico op nadelige gezondheidseffecten te minimaliseren.
| Gevarensymbolen | F+ (licht ontvlambaar) |
| Beveiligingsbeschrijving | Licht ontvlambaar gas. Veroorzaakt ernstige oogirritatie. Kan irritatie van de luchtwegen veroorzaken. |
| VN-identificatienummers | UN1080 |
| HS-code | 2903.39 |
| Gevarenklasse | 2.1 (ontvlambaar gas) |
| Verpakkingsgroep | Niet van toepassing omdat TFE een gas is |
| Toxiciteit | TFE heeft een lage acute toxiciteit, maar langdurige blootstelling kan leiden tot longschade en andere nadelige gevolgen voor de gezondheid. TFE wordt ook beschouwd als een potentieel carcinogeen voor de mens. |
Methoden voor de synthese van tetrafluorethyleen
Tetrafluorethyleen (TFE) kan op verschillende manieren worden gesynthetiseerd, waaronder thermische en katalytische ontleding van verschillende fluorkoolstofverbindingen.
Een gebruikelijke methode voor het synthetiseren van TFE is de thermische ontleding van chloordifluormethaan (CCl2F2) in aanwezigheid van een geschikte initiator bij hoge temperatuur. Het proces omvat het verbreken van koolstof-chloorbindingen in CCl2F2 om een radicaal te vormen, dat vervolgens reageert met andere moleculen om TFE te produceren.
Een andere methode is de katalytische ontleding van fluorkoolstofverbindingen zoals hexafluorpropeen (HFP) of octafluorcyclobutaan (OFCB) over een geschikte katalysator, zoals aluminiumchloride of antimoonpentafluoride, bij hoge temperatuur. Deze methode produceert een mengsel van TFE en andere fluorkoolstofbijproducten, die vervolgens worden gescheiden en gezuiverd.
Bovendien kan TFE worden gesynthetiseerd door elektrochemische fluorering, een proces waarbij een mengsel van waterstof en fluorgas over een metalen anode wordt geleid in aanwezigheid van een elektrolyt. Deze methode produceert een mengsel van TFE en andere gefluoreerde verbindingen, die vervolgens worden gescheiden en gezuiverd.
Over het algemeen vereist de synthese van TFE gespecialiseerde apparatuur en expertise vanwege de zeer reactieve en gevaarlijke aard van de betrokken chemicaliën. Daarom is het belangrijk om de juiste veiligheidsprotocollen en -voorschriften te volgen bij het synthetiseren van TFE.
Gebruik van tetrafluorethyleen
Tetrafluorethyleen (TFE) is een veelzijdige chemische stof met verschillende industriële en commerciële toepassingen.
- Een van de belangrijkste toepassingen van TFE is als monomeer voor de productie van polytetrafluorethyleen (PTFE), een niet-klevend, hittebestendig polymeer dat algemeen bekend staat als Teflon.
- TFE dient als grondstof voor de productie van andere gefluoreerde verbindingen, zoals geperfluoreerde carbonzuren en perfluoralkylsulfonaten, die toepassingen hebben in de elektronica, textiel en andere industrieën.
- TFE speelt een cruciale rol bij de productie van fluorpolymeren, zoals polyvinylideenfluoride (PVDF), die vanwege hun hoge chemische bestendigheid en duurzaamheid veel worden gebruikt in coatings, buizen en draden.
- Fabrikanten gebruiken TFE als koelmiddel in airconditioning- en koelsystemen en bij de productie van schuimisolatiematerialen.
- De farmaceutische industrie gebruikt TFE als oplosmiddel en drijfgas voor aërosolformuleringen.
- TFE heeft vele toepassingen, waaronder coatings voor kookgerei, elektrische isolatie en hoogwaardige pakkingen.
Over het geheel genomen maken de veelzijdigheid en unieke eigenschappen van TFE het tot een waardevolle chemische stof in een breed scala aan industriële en commerciële toepassingen. Het is echter belangrijk om de juiste veiligheidsprotocollen en -voorschriften te volgen bij het omgaan met TFE om het risico op nadelige gezondheidseffecten en milieuschade te minimaliseren.
Vragen:
Welke atomaire of hybride orbitalen vormen de sigmabinding tussen c2 en f in tetrafluorethyleen, c2f4?
De sigmabinding tussen C2 en F in tetrafluorethyleen (C2F4) wordt gevormd door de overlap van hybride orbitalen. In C2F4 is elk koolstofatoom sp2-gehybridiseerd, wat betekent dat de drie atomaire orbitalen (een 2s-orbitaal en twee 2p-orbitalen) samen drie sp2-gehybridiseerde orbitalen vormen, gerangschikt in een trigonale vlakke geometrie. Elk koolstofatoom heeft ook een ongehybridiseerde 2p-orbitaal, loodrecht op het vlak van de sp2-orbitalen.
Het fluoratoom heeft een enkelvoudig bezette 2p-orbitaal die overlapt met de ongehybridiseerde 2p-orbitaal van het aangrenzende koolstofatoom om de sigma-binding te vormen. Deze overlap vindt plaats van begin tot eind tussen de twee atomen, wat resulteert in een lineaire rangschikking van atomen in het molecuul. De elektronen in de sigma-binding bevinden zich voornamelijk in het gebied tussen de twee kernen, waardoor een sterke covalente binding ontstaat tussen de koolstof- en fluoratomen.
Teflon wordt geproduceerd uit gepolymeriseerd tetrafluorethyleen?
Ja, Teflon wordt geproduceerd door polymerisatie van tetrafluorethyleen (TFE). TFE is een kleurloos, geurloos gas dat in aanwezigheid van een katalysator kan worden gepolymeriseerd om polytetrafluorethyleen (PTFE) te vormen, algemeen bekend als Teflon.
Het polymerisatieproces omvat het initiëren van de reactie met behulp van een vrije radicaalinitiator zoals ammoniumpersulfaat of azobisisobutyronitril (AIBN), die vrije radicalen genereert die de kettingreactie initiëren van TFE-monomeren die tot PTFE zijn gepolymeriseerd.
