Tetrachloorkoolstof is een kleurloze vloeistof met een zoete geur. Het werd algemeen gebruikt als oplosmiddel, maar de productie en het gebruik ervan zijn afgenomen vanwege de schadelijke gevolgen voor de gezondheid en het milieu.
| IUPAC-naam | Tetrachloormethaan |
| Moleculaire formule | CCl4 |
| CAS-nummer | 56-23-5 |
| Synoniemen | Koolstoftet, Tetraform, Perchloormethaan, Tetrasol |
| InChi | InChI=1S/CCl4/c2-1(3,4)5 |
Eigenschappen van tetrachloorkoolstof
Formule van tetrachloorkoolstof
De chemische formule voor tetrachloorkoolstof is CCl4. Het vertegenwoordigt een molecuul dat bestaat uit een koolstofatoom gebonden aan vier chlooratomen. De formule biedt essentiële informatie over de elementaire samenstelling en rangschikking van atomen in de verbinding.
Koolstoftetrachloride Molaire massa
De molaire massa van tetrachloormethaan wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. Koolstof heeft een molaire massa van 12,01 g/mol, terwijl chloor een molaire massa heeft van 35,45 g/mol. Als deze waarden bij elkaar worden opgeteld, bedraagt de molaire massa van tetrachloormethaan ongeveer 153,82 g/mol.
Kookpunt van tetrachloorkoolstof
Tetrachloormethaan heeft een relatief hoog kookpunt van 76,72°C (170,1°F). Dit betekent dat bij standaard atmosferische druk de verbinding bij die temperatuur verandert van een vloeistof in een gas. Het kookpunt weerspiegelt de sterkte van de intermoleculaire krachten in de stof.
Koolstoftetrachloride Smeltpunt
Het smeltpunt van tetrachloormethaan is -22,92°C (-9,26°F). Dit is de temperatuur waarbij de vaste vorm van de verbinding in een vloeistof verandert. Het smeltpunt geeft inzicht in de sterkte van de bindingen die atomen binnen het kristalrooster bij elkaar houden.
Dichtheid van tetrachloorkoolstof g/ml
De dichtheid van tetrachloormethaan is ongeveer 1,586 g/ml. Dichtheid verwijst naar de massa van een stof per volume-eenheid. De dichtheid van tetrachloormethaan geeft aan dat het dichter is dan water, dat een dichtheid heeft van 1 g/ml.
Koolstoftetrachloride Molecuulgewicht
Het molecuulgewicht van tetrachloormethaan wordt berekend door de atoomgewichten van de samenstellende atomen op te tellen. Met één koolstofatoom (12,01 g/mol) en vier chlooratomen (elk 35,45 g/mol) bedraagt het molecuulgewicht van tetrachloormethaan ongeveer 153,82 g/mol.
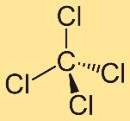
Structuur van tetrachloorkoolstof
De structuur van tetrachloormethaan bestaat uit een centraal koolstofatoom gebonden aan vier chlooratomen. Deze chlooratomen zijn symmetrisch rond het koolstofatoom gepositioneerd en vormen een tetraëdrische geometrie. Deze structuur draagt bij aan de eigenschappen en het gedrag van de verbinding.
Oplosbaarheid van tetrachloorkoolstof
Tetrachloormethaan is slecht oplosbaar in water, met een oplosbaarheid van ongeveer 0,8 g/l bij 20°C. Het vertoont echter een hogere oplosbaarheid in organische oplosmiddelen zoals ethanol, ether en benzeen. Oplosbaarheidseigenschappen worden beïnvloed door intermoleculaire krachten en de polariteit van de betrokken stoffen.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 1.586 |
| Kleur | N.v.t |
| Geur | Zacht |
| Molaire massa | 153,82 g/mol |
| Dikte | 1.586 g/ml |
| Fusie punt | -22,92°C (-9,26°F) |
| Kookpunt | 76,72°C (170,1°F) |
| Flitspunt | N.v.t |
| oplosbaarheid in water | 0,8 g/l bij 20°C |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals ethanol, ether en benzeen |
| Dampdruk | 11,9 mmHg bij 20°C |
| Dampdichtheid | 5,3 (lucht = 1) |
| pKa | N.v.t |
| pH | N.v.t |
Veiligheid en gevaren van tetrachloorkoolstof
Tetrachloormethaan brengt aanzienlijke veiligheidsrisico’s met zich mee. Het wordt als zeer giftig beschouwd en kan de menselijke gezondheid ernstig schaden. Het inademen van de dampen kan irritatie van de luchtwegen, duizeligheid, misselijkheid en zelfs lever- en nierschade veroorzaken. Huidcontact met vloeistof kan brandwonden en irritatie veroorzaken. De verbinding is ook een bekend kankerverwekkende stof, die op de lange termijn gezondheidsrisico’s met zich meebrengt. Bovendien is tetrachloormethaan gevaarlijk voor het milieu, met het potentieel om bodem en water te verontreinigen. Vanwege deze gevaren zijn de productie en het gebruik ervan aanzienlijk beperkt om de blootstelling te minimaliseren en zowel de menselijke gezondheid als het milieu te beschermen. De juiste protocollen voor hantering, opslag en verwijdering moeten worden gevolgd om de risico’s die met tetrachloormethaan gepaard gaan te beperken.
| Gevarensymbolen | T, Xn |
| Beveiligingsbeschrijving | Zeer giftig; Schadelijk |
| VN-identificatienummers | Een 1846 |
| HS-code | 2903.14.0000 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | II |
| Toxiciteit | Acute toxiciteit, kankerverwekkend |
Methoden voor de synthese van tetrachloorkoolstof
Tetrachloormethaan kan op verschillende manieren worden gesynthetiseerd. Een gebruikelijke methode omvat de reactie tussen chloorgas (Cl2) en koolstofdisulfide (CS2) in aanwezigheid van een katalysator zoals aluminiumchloride (AlCl3).
In dit proces reageert chloorgas met koolstofdisulfidedamp om tetrachloormethaan en zwavel te produceren. De reactie verloopt als volgt:
Cl2 + CS2 → CCl4 + S
Een andere methode omvat de reactie tussen methaan (CH4) en chloorgas. Onder gecontroleerde omstandigheden reageert methaan met chloor in aanwezigheid van ultraviolet (UV) licht of warmte, waarbij tetrachloormethaan en waterstofchloride worden geproduceerd. De reactie verloopt als volgt:
CH4 + 4Cl2 → CCl4 + 4HCl
Chlorering van koolstofdisulfide met waterstofchloride (HCl) als chloreringsmiddel produceert tetrachloormethaan. Voor deze reactie is een katalysator nodig, zoals ijzer(III)chloride (FeCl3). De reactie verloopt als volgt:
CS2 + 3HCl + FeCl3 → CCl4 + S + 2FeCl2
Bij het synthetiseren van tetrachloormethaan moeten individuen voorzichtig zijn vanwege de gevaarlijke aard van de verbinding. Ze moeten strikte veiligheidsmaatregelen en geschikte apparatuur gebruiken om hun welzijn te garanderen en milieuverontreiniging te voorkomen.
Gebruik van tetrachloorkoolstof
Bij verschillende toepassingen is gebruik gemaakt van de unieke eigenschappen van tetrachloormethaan. Hier zijn enkele toepassingen:
- Oplosmiddel: Tetrachloormethaan, eenmaal opgeloste oliën, vetten, rubber en was, dient als oplosmiddel. De toxiciteit en milieuproblemen hebben het gebruik van oplosmiddelen echter aanzienlijk verminderd.
- Brandblusser: Tetrachloormethaan wordt gebruikt om bepaalde soorten branden waarbij elektrische apparatuur en brandbare vloeistoffen betrokken zijn, te blussen. Veiligere alternatieven en hun schadelijke effecten hebben ertoe geleid dat het gebruik ervan geleidelijk is stopgezet.
- Chemisch tussenproduct: Tetrachloormethaan heeft gediend als chemisch tussenproduct bij de productie van verschillende verbindingen, zoals koelmiddelen, pesticiden en farmaceutische producten.
- Reinigingsmiddel: Industrieën gebruikten voorheen tetrachloormethaan als reinigingsmiddel voor metalen oppervlakken en elektronische componenten. Gezondheids- en milieurisico’s hebben echter geleid tot een voorkeur voor veiligere alternatieven.
- Laboratoriumreagens: Tetrachloormethaan wordt soms gebruikt als reagens of oplosmiddel voor specifieke reacties en extracties in het laboratorium. Chemici geven over het algemeen de voorkeur aan veiligere alternatieven en beperken het gebruik ervan.
Het is van cruciaal belang op te merken dat veel van deze toepassingen zijn afgenomen of zelfs helemaal zijn stopgezet vanwege de schadelijke effecten van tetrachloormethaan op de menselijke gezondheid en het milieu. Als gevolg hiervan is het gebruik van tetrachloormethaan aanzienlijk afgenomen en zijn in verschillende industrieën alternatieve stoffen ingevoerd die minder giftig zijn en minder impact hebben op het milieu.
Vragen:
Vraag: Kun je nog steeds vervangingsmiddelen voor tetrachloorkoolstof kopen?
A: Ja, er zijn alternatieven voor tetrachloormethaan die veiliger zijn en een lagere impact hebben op het milieu.
Vraag: Kun je nog steeds tetrachloorkoolstof kopen?
A: Tetrachloormethaan is in veel landen aan beperkingen onderhevig vanwege de toxiciteit en milieurisico’s ervan, dus de beschikbaarheid ervan voor aankoop is beperkt.
Vraag: Is tetrachloorkoolstof legaal?
A: Tetrachloormethaan is in veel landen onderworpen aan wettelijke beperkingen vanwege de schadelijke gevolgen voor de gezondheid en het milieu.
Vraag: Is tetrachloorkoolstof een alkalisch of een zuur?
A: Tetrachloormethaan is noch alkalisch noch zuur; het is een neutrale verbinding.
Vraag: Is tetrachloorkoolstof polair of niet-polair?
A: Tetrachloormethaan is een niet-polair molecuul vanwege de symmetrische tetraëdrische structuur, die resulteert in een gelijke verdeling van elektronen.
Vraag: Wat is de molaire massa van tetrachloorkoolstof?
A: De molaire massa van tetrachloormethaan is ongeveer 153,82 g/mol.
Vraag: Wat is tetrachloorkoolstof?
A: Tetrachloormethaan is een kleurloze vloeibare verbinding die in het verleden voornamelijk als oplosmiddel werd gebruikt, maar het gebruik ervan is nu beperkt vanwege de toxiciteit en milieuproblemen.
Vraag: Wat is de chemische formule van tetrachloorkoolstof?
A: De chemische formule voor tetrachloormethaan is CCl4.
Vraag: Bestaat de binding uit tetrachloorkoolstof?
A: De binding in tetrachloormethaan is covalent, met vier covalente bindingen tussen het centrale koolstofatoom en de omringende chlooratomen.
Vraag: Is tetrachloorkoolstof ionisch of covalent?
A: Tetrachloormethaan is een covalente verbinding omdat het bindingen vormt door elektronen te delen tussen koolstof- en chlooratomen.
Vraag: Hoeveel chlooratomen zitten er in het koolstoftetrachloridemolecuul?
A: Er zijn vier chlooratomen in het tetrachloormethaanmolecuul.
Vraag: Identificeer voor elke opgeloste stof het beste oplosmiddel: water of tetrachloorkoolstof?
A: Het beste oplosmiddel hangt af van de opgeloste stof. Water is over het algemeen een beter oplosmiddel voor polaire stoffen, terwijl tetrachloormethaan beter is voor niet-polaire stoffen.
Vraag: Lewis-structuur van tetrachloormethaan?
A: In de Lewis-structuur van tetrachloormethaan is het centrale koolstofatoom gebonden aan vier chlooratomen, zonder losse paren op het centrale koolstofatoom.
