Propyleen (C3H6) is een kleurloos, brandbaar gas dat veel wordt gebruikt bij de productie van kunststoffen en synthetische vezels. Het wordt ook gebruikt als brandstof in las- en snijbranders.
| Naam van IUPAC | Propeen |
| Moleculaire formule | C3H6 |
| CAS-nummer | 115-07-1 |
| Synoniemen | Propeen, methylethyleen, prop-1-een, methylethyleen |
| InChi | InChI=1S/C3H6/c1-3-2/h3H,1-2H3 |
Eigenschappen van propyleen
Propyleenformule
De chemische formule voor propyleen is C3H6. Dit betekent dat elk propyleenmolecuul drie koolstofatomen en zes waterstofatomen bevat. De formule is belangrijk bij chemische reacties omdat deze het aantal en de typen atomen aangeeft die in elk molecuul aanwezig zijn. De propyleenformule wordt vaak gebruikt bij de productie van kunststoffen, synthetische vezels en andere industriële materialen.
Propyleen molaire massa
Propeen, ook wel propeen genoemd, heeft een molaire massa van 42,08 g/mol. Dit betekent dat één mol propeenmoleculen 42,08 gram weegt. Molaire massa is belangrijk bij chemische berekeningen omdat we hiermee de massa en het aantal mol van een stof kunnen omrekenen. Om de molaire massa van propeen te berekenen, tellen we de atoommassa’s van de samenstellende atomen op: drie koolstofatomen, elk met een massa van 12,01 amu, en zes waterstofatomen, elk met een massa van 1,01 amu.
Kookpunt van propyleen
Het kookpunt van propeen is -47,6°C (-53,7°F). Dit betekent dat propeen bij normale atmosferische druk kookt en bij -47,6°C in een gas verandert. Kookpunt is een belangrijke fysische eigenschap van propeen, omdat het de omstandigheden bepaalt waaronder de stof zal veranderen van een vloeistof in een gas. Het lage kookpunt van propeen maakt het nuttig als koelmiddel en bij de productie van chemicaliën.
Propyleen smeltpunt
Propeen heeft geen goed gedefinieerd smeltpunt omdat het bij verhitting een geleidelijke overgang ondergaat van vast naar vloeibaar. Het smelttraject van propeen is echter ongeveer -185 tot -135 °C (-301 tot -211 °F). Dit betekent dat propeen begint te smelten bij ongeveer -185°C en volledig zal smelten bij ongeveer -135°C. Het smeltpunt is belangrijk bij het bepalen van de omstandigheden waaronder propeen zal veranderen van vast naar vloeibaar.
Dichtheid van propyleen g/ml
De dichtheid van propeen is 0,74 g/ml bij kamertemperatuur (25°C). Dit betekent dat één milliliter propeen 0,74 gram weegt. Dichtheid is een belangrijke fysieke eigenschap van propeen omdat deze helpt bij het bepalen van de massa van een bepaald volume van de stof. De lage dichtheid van propeen maakt het nuttig in toepassingen waarbij een lichtgewicht materiaal vereist is.
Propyleen Molecuulgewicht
Het molecuulgewicht van propeen is 42,08 g/mol. Deze waarde is de som van de atoomgewichten van alle atomen in één propeenmolecuul. Het molecuulgewicht is een belangrijke eigenschap omdat we hiermee de hoeveelheid van een stof in mol kunnen berekenen op basis van de massa, of omgekeerd.
Propyleen structuur
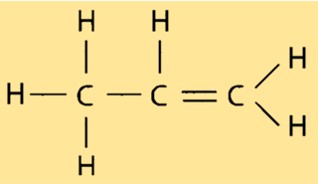
Propeen heeft een lineaire moleculaire structuur, waarbij elk koolstofatoom gebonden is aan twee waterstofatomen en één ander koolstofatoom. De dubbele binding tussen de twee koolstofatomen geeft propeen zijn reactieve karakter en maakt het bruikbaar in diverse industriële toepassingen. De structuur van propeen is belangrijk bij het bepalen van de eigenschappen ervan, zoals het kook- en smeltpunt.
| Verschijning | Kleurloos gas |
| Soortelijk gewicht | 0,97 |
| Kleur | Kleurloos |
| Geur | Licht zoete geur, vergelijkbaar met benzine |
| Molaire massa | 42,08 g/mol |
| Dikte | 0,74 g/ml (bij 25°C) |
| Fusie punt | -185 tot -135°C (-301 tot -211°F) |
| Kookpunt | -47,6°C (-53,7°F) |
| Flitspunt | -108°C (-162°F) |
| oplosbaarheid in water | 0,075 g/100 ml (bij 20°C) |
| Oplosbaarheid | Oplosbaar in aceton, ethanol, ether |
| Dampdruk | 50,6 kPa (bij 25°C) |
| Dampdichtheid | 1,45 (ten opzichte van lucht) |
| pKa | 44 |
| pH | Niet van toepassing (propyleen is noch zuur, noch basisch) |
Veiligheid en gevaren van propyleen
Propeen wordt over het algemeen beschouwd als een relatief veilige stof om mee te werken, maar brengt wel enkele gevaren met zich mee. Het is zeer brandbaar en kan gemakkelijk vlam vatten. Het moet daarom uit de buurt van ontstekingsbronnen worden opgeslagen en gehanteerd. Contact met de huid of ogen kan irritatie veroorzaken, en inademing van hoge concentraties propeen kan duizeligheid en zelfs bewustzijnsverlies veroorzaken. Zoals bij elke chemische stof is het belangrijk om de juiste veiligheidsprocedures te volgen bij het hanteren van propeen, zoals het dragen van beschermende kleding zoals handschoenen en een veiligheidsbril en het zorgen voor voldoende ventilatie. In geval van accidentele blootstelling of inslikken, dient u onmiddellijk medische hulp in te roepen.
| Gevarensymbolen | Licht ontvlambaar (F+) |
| Beveiligingsbeschrijving | Verwijderd houden van ontstekingsbronnen. Gebruik in goed geventileerde ruimtes. |
| VN-identificatienummers | VN 1077 |
| HS-code | 2901.10.00 |
| Gevarenklasse | 2.1 (ontvlambaar gas) |
| Verpakkingsgroep | groep A |
| Toxiciteit | Wordt niet als giftig beschouwd |
Propeensynthesemethoden
Verschillende methoden kunnen propeen synthetiseren, waaronder stoomkraken van koolwaterstoffen, dehydrogenering van propaan en katalytisch kraken met vloeistof.
Stoomkraken is de meest gebruikelijke methode voor propeensynthese. Hierbij worden koolwaterstofgrondstoffen, zoals ethaan, propaan of nafta, bij hoge temperaturen verwarmd in aanwezigheid van stoom. Het proces omvat het afkoelen en scheiden van het resulterende koolwaterstofmengsel om het propeen als een afzonderlijk product te isoleren.
Propaandehydrogenering is een andere methode om propeen te synthetiseren. Dit omvat het laten reageren van propaan met een katalysator om waterstof te verwijderen en propeen te produceren. Deze methode is aantrekkelijk omdat propaan gemakkelijk verkrijgbaar en goedkoop is.
Het vloeistofkatalytische kraakproces maakt gebruik van een katalysator om zware koolwaterstoffen om te zetten in lichtere producten, waaronder propeen, door grotere moleculen in kleinere moleculen af te breken.
Gebruik van propyleen
Propeen is een veelzijdige chemische stof die vele toepassingen kent in verschillende industrieën. Hier zijn enkele van de meest voorkomende toepassingen voor propeen:
- Polypropyleenproductie: Speelt een cruciale rol als primaire grondstof bij de productie van polypropyleen, een veelzijdig materiaal dat in verschillende toepassingen wordt gebruikt, zoals verpakkingen, textiel en auto-onderdelen.
- Brandstof: Wordt gebruikt als brandstof in veel industriële toepassingen, zoals autogeen snijden en lassen.
- Oplosmiddel: Dient als een nuttig oplosmiddel voor een verscheidenheid aan chemicaliën en mensen gebruiken het in veel toepassingen, waaronder de extractie van essentiële oliën.
- Koelmiddel: Wordt in sommige systemen als koelmiddel gebruikt, vooral in toepassingen waar het gebruik van andere koelmiddelen beperkt is.
- Chemisch tussenproduct: Gebruikt als chemisch tussenproduct bij de productie van vele andere chemicaliën, zoals propyleenoxide, acrylonitril en butyraldehyde.
- Voedselverpakking: gebruikt bij de productie van voedselverpakkingsmaterialen, zoals films en containers.
- Producten voor persoonlijke verzorging: Veel producten voor persoonlijke verzorging, zoals vochtinbrengende crèmes en haarverzorgingsproducten, gebruiken propyleenglycol, een derivaat van propeen.
Vragen:
Vraag: Welke reactie moet worden gebruikt om propeen om te zetten in alkylhalogenide?
A: Propeen kan worden omgezet in een alkylhalogenide door een reactie met waterstofhalogeniden, zoals waterstofchloride (HCl) of waterstofbromide (HBr).
Vraag: Wat is de empirische formule voor propeen (c3h6)?
A: De empirische formule voor propeen (C3H6) is CH2.
Vraag: Is propeen oplosbaar in water?
A: Propeen is niet oplosbaar in water omdat het een niet-polaire verbinding is en water een polair oplosmiddel.
Vraag: Wat zijn de formulemassa’s van propeen, C3H6?
A: De formulemassa van propeen (C3H6) is ongeveer 42,08 g/mol.
Vraag: Wat is de empirische formule voor de volgende molecuulformule: C3H6?
A: De empirische formule voor C3H6 is CH2.
Vraag: Hoe kun je experimenteel aantonen dat de molecuulformule van propeen C3H6 is en niet CH2?
A: Een experimentele methode voor het bepalen van de molecuulformule van propeen is het analyseren van de verbrandingsproducten ervan. Als propeen met een teveel aan zuurstof wordt verbrand, zijn de producten koolstofdioxide en water. Door de geproduceerde hoeveelheden koolstofdioxide en water te meten, kan worden bepaald dat de molecuulformule van propeen C3H6 is in plaats van CH2.
