Propaanzuur of C3H6O2 is een kleurloos vloeibaar carbonzuur met een scherpe geur. Het wordt onder meer gebruikt bij de productie van geneesmiddelen, herbiciden en conserveermiddelen voor levensmiddelen.
| IUPAC-naam | Propaanzuur |
| Moleculaire formule | C3H6O2 |
| CAS-nummer | 79-09-4 |
| Synoniemen | Propionzuur, methylazijnzuur, ethylmierenzuur, propanylmierezuur, propionzuuroplossing, enz. |
| InChi | InChI=1S/C3H6O2/c1-2-3(4)5/h2H2.1H3,(H.4.5) |
Structuur van propaanzuur
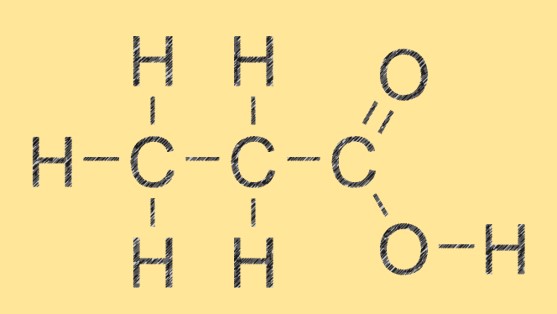
Propaanzuur heeft een eenvoudige lineaire structuur bestaande uit drie koolstofatomen, zes waterstofatomen en twee zuurstofatomen. De carbonzuurgroep (-COOH) is gebonden aan het tweede koolstofatoom van het molecuul. Door deze structuur kan propaanzuur sterke waterstofbruggen vormen met andere propaanzuurmoleculen en met andere verbindingen die waterstofbrugacceptoren of donoren hebben.
Kookpunt van propaanzuur
Het kookpunt van propaanzuur is 141,1°C. Deze waarde wordt beïnvloed door de intermoleculaire krachten die in de verbinding aanwezig zijn. Propaanzuur heeft een relatief hoog kookpunt in vergelijking met andere eenvoudige carbonzuren vanwege het vermogen om sterke waterstofbruggen te vormen. Deze eigenschap maakt propaanzuur tot een nuttig oplosmiddel in de organische chemie.
Propaanzuurformule
De chemische formule voor propaanzuur is C3H6O2. Deze formule vertegenwoordigt het exacte aantal en type atomen in een enkel molecuul propaanzuur. De formule kan worden gebruikt om de molaire massa, het molecuulgewicht en de stoichiometrische verhoudingen te berekenen bij chemische reacties waarbij propaanzuur betrokken is.
Molaire massa propionzuur
Propionzuur heeft een molaire massa van 74,08 g/mol. Het is een eenvoudig organisch carbonzuur met drie koolstofatomen, zes waterstofatomen en twee zuurstofatomen. Molaire massa is een belangrijke parameter in de chemie omdat deze wordt gebruikt om de hoeveelheid stof in een bepaald monster te bepalen. Het wordt ook gebruikt bij stoichiometrische berekeningen om de hoeveelheid reactant of product in een chemische reactie te bepalen.
Smeltpunt van propionzuur
Propionzuur heeft een smeltpunt van -20,8°C. Dit lage smeltpunt is het gevolg van de zwakke intermoleculaire krachten die in de verbinding aanwezig zijn. Propionzuur is vloeibaar bij kamertemperatuur en kan bij lage temperaturen gemakkelijk stollen.
Dichtheid van propionzuur g/ml
Propionzuur heeft een dichtheid van 0,99 g/ml bij kamertemperatuur. Deze eigenschap wordt beïnvloed door het molecuulgewicht en de pakkingsdichtheid van de moleculen van de verbinding. De dichtheid van propionzuur maakt het minder dicht dan water, waardoor het op het wateroppervlak kan drijven.
Molecuulgewicht van propionzuur
Het molecuulgewicht van propionzuur is 74,08 g/mol. Deze waarde wordt berekend door de atoomgewichten van de samenstellende atomen van het molecuul op te tellen. Het molecuulgewicht van propionzuur wordt gebruikt om de molaire massa en het aantal mol van de verbinding in een bepaald monster te bepalen.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 0,99 g/ml |
| Kleur | Kleurloos |
| Geur | Akko |
| Molaire massa | 74,08 g/mol |
| Dikte | 0,99 g/ml |
| Fusie punt | -20,8°C |
| Kookpunt | 141,1°C |
| Flitspunt | 60°C |
| oplosbaarheid in water | Mengbaar |
| Oplosbaarheid | Oplosbaar in ethanol, ether, aceton |
| Dampdruk | 1,5 mmHg bij 25°C |
| Dampdichtheid | 2,5 (tegen lucht) |
| pKa | 4,87 |
| pH | 2,8 (1M-oplossing) |
Opmerking: de waarden in de tabel zijn bij benadering en kunnen variëren afhankelijk van de gegevensbron.
Propaanzuur Veiligheid en gevaren
Onjuiste omgang met propaanzuur kan veiligheids- en gezondheidsrisico’s met zich meebrengen. Deze stof is bijtend en kan bij inademing ernstige huid- en oogirritatie en ademhalingsproblemen veroorzaken. Bovendien is propaanzuur brandbaar en kan het explosieve mengsels vormen met lucht. Om de veiligheid te garanderen, bewaart u het apparaat in een koele, droge, goed geventileerde ruimte, uit de buurt van hittebronnen, vonken of vlammen. Draag bij het hanteren van deze stof beschermende uitrusting zoals handschoenen, een veiligheidsbril en een gasmasker om contact met de huid en ogen of het inademen van dampen te voorkomen. Zoek onmiddellijk medische hulp als het wordt ingeslikt of als het in contact komt met de huid en ogen.
| Gevarensymbolen | Corrosief (C) |
| Beveiligingsbeschrijving | S26-S36/37/39-S45 |
| AN-identificaties | Een 1848 |
| HS-code | 2915.90.10 |
| Gevarenklasse | 8 (corrosief materiaal) |
| Verpakkingsgroep | III |
| Toxiciteit | LD50 (oraal, rat) = 1,26 g/kg |
Methoden voor propaanzuursynthese
Propionzuur kan op verschillende manieren worden gesynthetiseerd. Een gebruikelijke methode is propyleenoxidatie, waarbij propyleen in aanwezigheid van een katalysator, meestal een metaaloxide, met lucht wordt omgezet om acroleïne te vormen. Acroleïne wordt vervolgens geoxideerd om acrylzuur te vormen, dat vervolgens via een decarboxyleringsreactie wordt omgezet in propionzuur.
Een andere methode omvat ethyleencarboxylering, waarbij ethyleen wordt omgezet in kooldioxide en water in aanwezigheid van een katalysator, gewoonlijk een metaalzout of palladiumcomplex, om ethyleen te vormen. aceetaldehyde. Aceetaldehyde wordt vervolgens geoxideerd tot azijnzuur, dat vervolgens via een decarboxyleringsreactie wordt omgezet in propaanzuur.
Een derde methode omvat hydrolyse van ethylcyanide, waarbij ethylcyanide in aanwezigheid van een sterk zuur of sterke base met water wordt omgezet om propionzuur te vormen.
Een vierde methode omvat koolhydraatfermentatie, waarbij bacteriën zoals Propionibacterium freudenreichii worden gebruikt om suikers om te zetten in propionzuur. Deze methode wordt vaak gebruikt in de voedingsindustrie om propionzuur te produceren voor gebruik als conserveermiddel.
Over het algemeen bieden deze methoden verschillende opties voor de synthese van propionzuur, afhankelijk van de gewenste zuiverheid, opbrengst en impact op het milieu.
Gebruik van propaanzuur
- De voedingsindustrie gebruikt propaanzuur als conserveermiddel om de groei van bacteriën en schimmels in gebak, zuivelproducten en voedsel voor huisdieren te voorkomen.
- Propionzuur dient als chemisch tussenproduct bij de productie van andere chemicaliën, waaronder esters die worden gebruikt bij de productie van parfums, smaakstoffen en kunststoffen.
- Propionzuuranhydride, geproduceerd uit propaanzuur, wordt gebruikt als oplosmiddel en reagens bij de organische synthese.
- De farmaceutische industrie gebruikt propaanzuur als grondstof bij de synthese van medicijnen als ibuprofen, naproxen en fenoprofen.
- Propionzuur wordt ook gebruikt bij de productie van herbiciden en insecticiden.
- Celluloseacetaatpropionaat, een coating voor farmaceutische producten en een bestanddeel van verven, vernissen en coatings, wordt geproduceerd uit propionzuur.
Over het geheel genomen heeft propionzuur een breed scala aan toepassingen vanwege zijn antibacteriële en conserverende eigenschappen, evenals zijn veelzijdigheid als chemisch tussenproduct.
Vragen:
Van welke verbinding kan worden voorspeld dat deze chemische eigenschappen heeft die vergelijkbaar zijn met die van propaanzuur (ch3ch2cooh)?
Propionzuur (CH3CH2COOH) voorspelt dat verbindingen met een vergelijkbare chemische structuur vergelijkbare chemische eigenschappen zullen hebben. Butaanzuur (CH3CH2CH2COOH) is een verbinding met een structuur die lijkt op propionzuur, met een toegevoegde methyleengroep in de koolstofketen. Verwacht wordt dat deze extra methyleengroep de polariteit en zuurgraad van het molecuul zal beïnvloeden, maar beide verbindingen hebben analoge kenmerken, zoals het zijn van zwakke organische zuren.
De voedingsindustrie gebruikt butaanzuur als conserveermiddel en dient als chemisch tussenproduct bij de productie van esters, oplosmiddelen en farmaceutische producten, vergelijkbaar met propaanzuur. Butaanzuur kan in sommige toepassingen ook propionzuur vervangen omdat het een nauwe pKa-waarde heeft.
Is propaanzuur een sterk zuur?
Propaanzuur is een zwak zuur. De pKa bedraagt ongeveer 4,87, wat aangeeft dat het bij een chemische reactie niet gemakkelijk een proton afstaat aan een base.
Ter vergelijking: sterke zuren zoals zoutzuur (HCl) en zwavelzuur (H2SO4) hebben veel lagere pKa-waarden en doneren gemakkelijk protonen in chemische reacties. Hoewel het een zwak zuur is, is propionzuur bij sommige toepassingen nog steeds bruikbaar. Door de lage zuurgraad is het geschikt als conserveermiddel in de voedingsindustrie, omdat het effectief de groei van bacteriën en schimmels remt zonder de smaak of geur van voedingsproducten aan te tasten.
