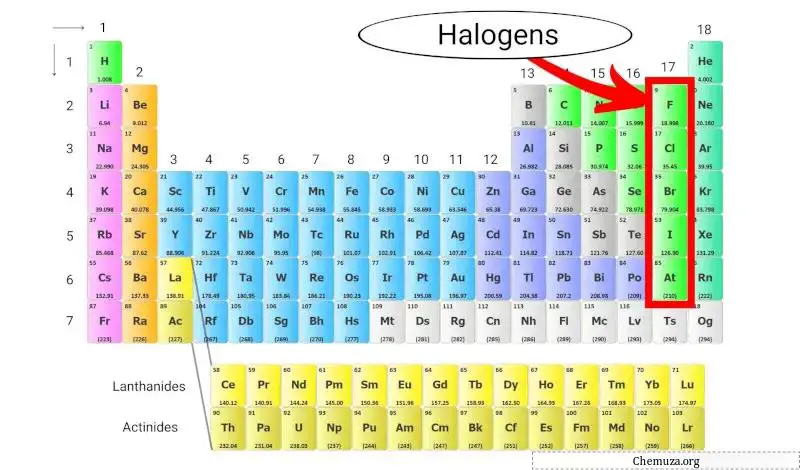
Halogenen zijn een groep elementen die voorkomen in groep 17 (ook wel de halogeengroep genoemd) van het periodiek systeem . Halogenen omvatten vijf verschillende elementen: fluor (F), chloor (Cl), broom (Br), jodium (I) en astatine (At).
Halogenen zijn uniek omdat ze de enige groep elementen zijn die verbindingen kunnen vormen met alle andere elementen in het periodiek systeem.
Laten we halogenen verder onderzoeken.
Wat zijn halogenen? En waarom worden ze zo genoemd?
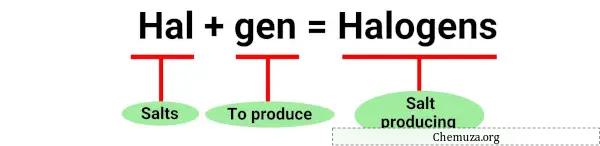
De term “halogeen” is afgeleid van de Griekse woorden “halo’s” die zout betekenen en “genen” die producent betekenen. [1]
Halogenen werden inderdaad voor het eerst ontdekt vanwege hun vermogen om zouten te produceren bij reactie met metalen .
Bijvoorbeeld:
Wanneer chloor (Cl 2 ) reageert met natrium (Na), vormt het natriumchloride (NaCl), een gewoon keukenzout:
2Na + Cl2 → 2NaCl
Op dezelfde manier vormt broom (Br 2 ) met kalium (K) kaliumbromide (KBr):
2K + Br2 → 2KBr
Deze reacties zijn voorbeelden van halogenen die zouten produceren wanneer ze reageren met metalen, vandaar de naam “halogeen”.
Het meest reactieve halogeen op het periodiek systeem
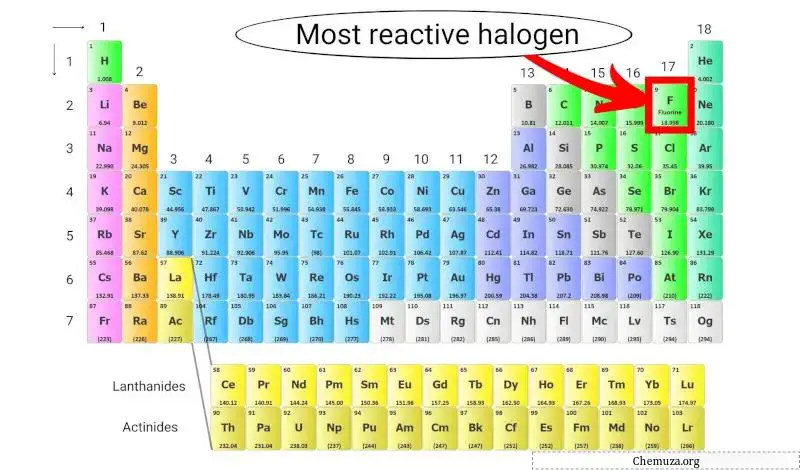
Fluor is het meest reactieve halogeen omdat het de hoogste elektronegativiteit heeft van alle elementen op het periodiek systeem, wat betekent dat het een sterke aantrekkingskracht heeft op elektronen.
Dit maakt het zeer reactief en kan reageren met bijna elk ander element op het periodiek systeem om verbindingen te vormen. [2]
Simpel gezegd: fluor is als een magneet voor elektronen en het zal er alles aan doen om een elektron te veroveren en de buitenste schil ervan te voltooien.
Het doet dit door te reageren met andere elementen en hun elektronen te stelen om nieuwe verbindingen te vormen.
Dit is de reden waarom fluor zo reactief is en waarom het nooit in zijn elementaire vorm in de natuur wordt aangetroffen, maar altijd als verbinding bestaat.
Vanwege de hoge reactiviteit is fluoride ook uiterst gevaarlijk en kan het onveilig zijn om te gebruiken.
Het wordt vaak verwerkt in gespecialiseerde laboratoria en wordt gebruikt in industriële processen om een breed scala aan chemicaliën en materialen te produceren.
Reactiviteit van halogenen
Halogenen zijn zeer reactief vanwege hun hogere elektronegativiteit, wat betekent dat ze een zeer hoog vermogen hebben om elektronen aan te trekken.
Bovendien hebben halogenen 7 elektronen in hun buitenste schil, en ze hebben slechts één extra elektron nodig om deze te vullen en een stabiele elektronische configuratie te bereiken, zoals edelgassen .
Je kunt bijvoorbeeld zien dat het Bohr-diagram voor fluor 7 elektronen in de buitenste schil heeft.
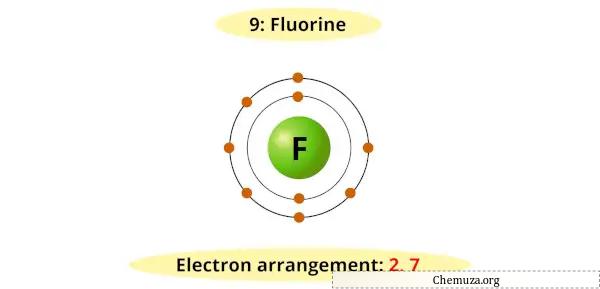
Er is nu 1 extra elektron nodig om een stabiel octet te verkrijgen (7 + 1 = 8).
Halogenen reageren met metalen en vormen ionische verbindingen, metaalhalogeniden genaamd, die heldere, kleurrijke vlammen kunnen produceren.
Ze reageren ook met niet-metalen zoals waterstof , zwavel en stikstof om een reeks covalente verbindingen te vormen. [3]
Daarom maakt de neiging van halogenen om een elektron te verkrijgen en een stabiele edelgasconfiguratie te verkrijgen, ze zeer reactief en in staat om verbindingen met andere elementen te vormen.
Periodieke halogeentrends
Naarmate we verder in de groep komen, vertonen de halogeenelementen zowel veranderingen in hun fysische eigenschappen als in hun chemische eigenschappen.
Laten we eens kijken naar de trends in sommige eigenschappen van halogenen.
- Atoomgrootte: Naarmate we lager in de groep komen, neemt de atomaire grootte van halogenen toe. Dit komt omdat elk halogeen één energieniveau meer heeft dan het energieniveau erboven, wat betekent dat de buitenste elektronen verder van de kern verwijderd zijn.
- Elektronegativiteit: Naarmate men lager in de groep komt, neemt de elektronegativiteit van halogeenelementen af. Dit betekent dat halogenen aan de top van de groep, zoals fluor en chloor, elektronegatiever zijn en daarom waarschijnlijker elektronen aantrekken dan die aan de onderkant, zoals jodium en astatine.
- Smeltpunten en kookpunten: Naarmate men lager in de groep komt, nemen de smelt- en kookpunten van halogenen toe. Grotere atomen hebben inderdaad meer elektronen en zijn in staat sterkere intermoleculaire krachten te vormen. [4]
- Reactiviteit ten opzichte van metalen: Naarmate men lager in de groep komt, neemt de reactiviteit van halogenen ten opzichte van metalen af. Dit betekent dat halogenen aan de top van de groep, zoals fluor en chloor, eerder reageren met metalen dan die aan de onderkant, zoals jodium en astatine.
Samenvatting
Halogenen zijn een groep van vijf elementen (fluor, chloor, broom, jodium en astatine) die voorkomen in groep 17 van het periodiek systeem. Ze zijn uniek in hun vermogen om verbindingen te vormen met alle andere elementen.
Halogenen zijn zeer reactief vanwege hun hoge elektronegativiteit en de neiging om een elektron op te nemen om een stabiele edelgasconfiguratie te bereiken. Fluor is het meest reactieve halogeen vanwege zijn hoge elektronegativiteit.
Naarmate men lager in de groep komt, vertonen halogenen veranderingen in hun fysische en chemische eigenschappen, zoals een toename van de atomaire grootte, een afname van de elektronegativiteit en een toename van de smelt- en kookpunten. De reactiviteit van halogenen ten opzichte van metalen neemt ook af naarmate men lager in de groep komt.
