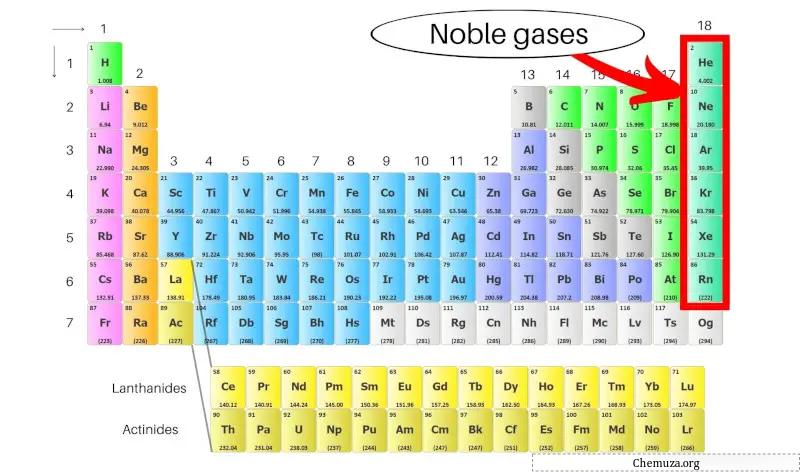
Edelgassen, ook wel inerte gassen genoemd, zijn een groep elementen in de meest rechtse kolom van het periodiek systeem . Ze omvatten helium (He), neon (Ne), argon (Ar), krypton (Kr), xenon (Xe) en radon (Rn).
Deze elementen staan bekend om hun lage reactiviteit vanwege hun buitenste complete elektronische omhulsels, waardoor ze stabiel en niet-reactief zijn met andere elementen. [1]
Laten we meer van de edelgassen in het periodiek systeem onderzoeken.
Wat zijn edelgassen?
Edelgassen zijn elementen uit Groep 18 die worden gekenmerkt door hun zeer lage reactiviteit met andere stoffen, wat betekent dat ze over het algemeen geen verbindingen vormen met andere elementen.
Ze worden ook wel inerte gassen genoemd omdat ze zeer stabiel zijn en niet gemakkelijk reageren met andere stoffen. Edelgassen zijn onder meer helium, neon, argon, krypton, xenon en radon.
Edelgassen worden in kleine hoeveelheden aangetroffen in de atmosfeer van de aarde en worden gebruikt in een verscheidenheid aan toepassingen, zoals verlichting, lassen en cryogene techniek. [2]
Waarom zijn edele inerte gassen?
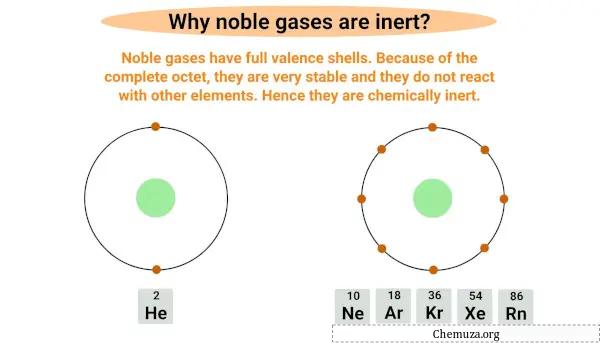
Edelgassen zijn inert of niet-reactief omdat ze een volledige buitenste elektronenschil hebben, ook wel de valentieschil genoemd.
De valentieschil is de buitenste schil van elektronen die een atoom omringt en de valentie-elektronen bevat, de elektronen die betrokken zijn bij chemische reacties.
Edelgassen zijn volledig octet , wat betekent dat ze een volledige valentieschil hebben met acht elektronen, behalve helium dat slechts twee elektronen in de buitenste schil heeft.
Het hebben van een volledige byte maakt ze zeer stabiel en het is onwaarschijnlijk dat ze met andere elementen reageren.
Bij chemische reacties hebben elementen de neiging elektronen te winnen of te verliezen om een volledig octet in hun valentieschil te krijgen, maar aangezien edelgassen al een volledige valentieschil hebben, hoeven ze geen elektronen te winnen of te verliezen.
Deze stabiele configuratie van edelgassen is te danken aan hun elektronische configuratie.
De buitenste elektronenschil van deze elementen is vol en ze hoeven dus geen elektronen op te nemen of te verliezen.
Dit betekent dat ze zeer niet-reactief zijn en niet de neiging hebben chemische bindingen met andere elementen te vormen.
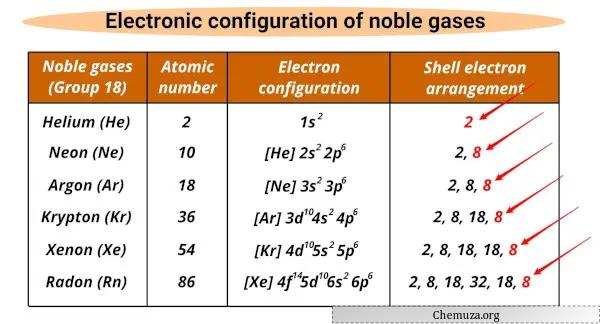
Lijst met edelgassen en hun elektronische configuraties
De edelgassen en hun elektronische configuraties worden hieronder weergegeven.
Wat hebben alle edelgassen gemeen?
Edelgassen hebben enkele gemeenschappelijke eigenschappen gemeen.
Ze hebben allemaal hetzelfde aantal valentie-elektronen (8), behalve helium dat er 2 heeft.
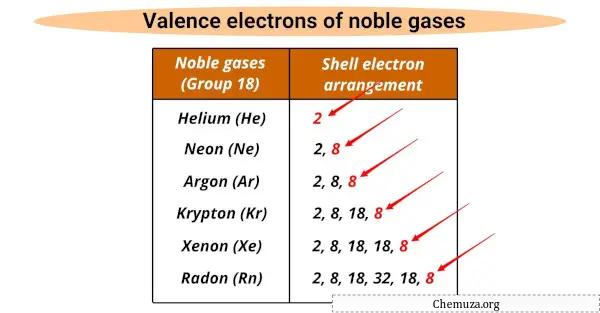
Valentie-elektronen zijn de buitenste elektronen in een atoom die deelnemen aan chemische reacties, en edelgassen hebben een volledige valentieschil waardoor ze niet-reactief zijn.
Bovendien zijn edelgassen kleurloze gassen die we niet kunnen zien, en ze zijn ook geurloos , wat betekent dat ze geen geur hebben. [3]
Ten slotte bestaan ze van nature als mono-atomaire gassen, wat betekent dat ze slechts één atoom in hun elementaire vorm hebben.
In tegenstelling tot de meeste andere elementen die de neiging hebben moleculen te vormen door zich aan andere atomen te binden, hoeven edelgassen zich niet aan andere atomen te binden omdat ze een volledige valentieschil hebben, waardoor ze zeer stabiel en niet-reactief zijn.
Samenvatting
Edelgassen zijn een groep elementen die in de meest rechtse kolom van het periodiek systeem voorkomen, waaronder helium, neon, argon, krypton, xenon en radon.
Ze worden gekenmerkt door hun lage reactiviteit vanwege hun volledig externe elektronische lagen. Edelgassen zijn inert of niet-reactief omdat ze een volledige valentieschil hebben, waardoor ze zeer stabiel zijn en het onwaarschijnlijk is dat ze met andere elementen reageren.
Edelgassen delen gemeenschappelijke eigenschappen, waaronder hetzelfde aantal valentie-elektronen (8 behalve helium dat er 2 heeft), een kleurloos en geurloos gas, en bestaan van nature als mono-atomaire gassen.
Ze worden gebruikt in verschillende toepassingen, zoals verlichting, lassen en cryogene techniek, maar ook als koelmiddelen in kernreactoren en als vulstof voor gloeilampen.
