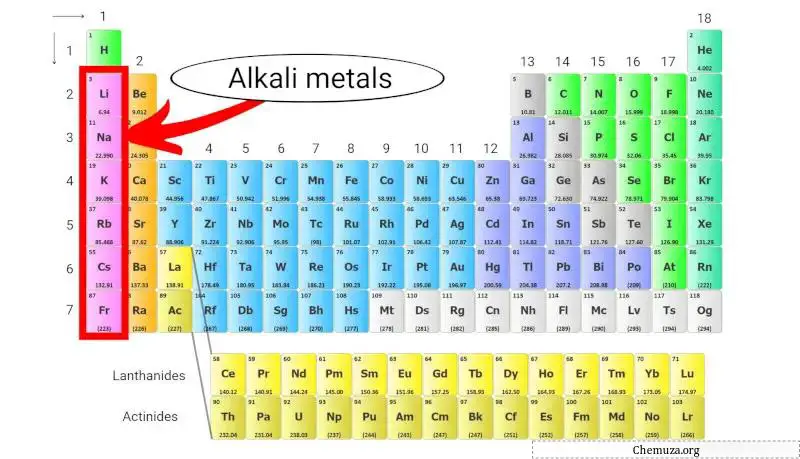
Alkalimetalen zijn een groep chemische elementen die zich in de eerste kolom van het periodiek systeem bevinden. Deze groep omvat lithium , natrium , kalium , rubidium , cesium en frankium .
Alkalimetalen zijn zacht en hebben lage smelt- en kookpunten. Ze worden vaak gebruikt in batterijen, legeringen en verschillende chemische reacties.
Laten we meer ontdekken over de alkalimetalen in het periodiek systeem.
Wat zijn alkalimetalen?

Alkalimetalen zijn een groep chemische elementen in het periodiek systeem die tot groep 1 behoren.
Deze elementen staan bekend om hun zachtheid, lage smeltpunten, hoge reactiviteit en vermogen om alkalische oplossingen te vormen bij reactie met water.
Enkele van de belangrijkste eigenschappen van alkalimetalen zijn:
- Ze hebben lage elektronegativiteiten en ionisatie-energieën, wat betekent dat ze de neiging hebben gemakkelijk elektronen te verliezen en kationen te vormen.
- Ze hebben lage smelt- en kookpunten, waardoor ze relatief zacht en gemakkelijk te smelten zijn.
- Ze hebben een hoge reactiviteit met water en zuurstof, waardoor ze reactief zijn in lucht en water.
- Ze zijn goede geleiders van warmte en elektriciteit.
Waarom worden alkalimetalen zo genoemd?

Alkalimetalen worden zo genoemd omdat ze in staat zijn sterk alkalische (basische) oplossingen te vormen wanneer ze reageren met water. [1]
Wanneer deze metalen in contact komen met water, laten ze waterstofgas vrij en vormen ze hydroxide-ionen, die de oplossing een basische pH geven.
Uitleg:
De reactiviteit van alkalimetalen met water is te danken aan hun lage ionisatie-energieën [2] , wat betekent dat ze gemakkelijk elektronen kunnen verliezen en positieve ionen (kationen) kunnen vormen.
Wanneer ze in contact komen met water, ondergaan ze een chemische reactie waarbij ze elektronen verliezen en reageren met watermoleculen om hydroxide-ionen en waterstofgas te vormen.
Bij deze reactie komt veel warmte vrij, waardoor het waterstofgas kan ontbranden en exploderen.
Volgorde van reactiviteit van alkalimetalen
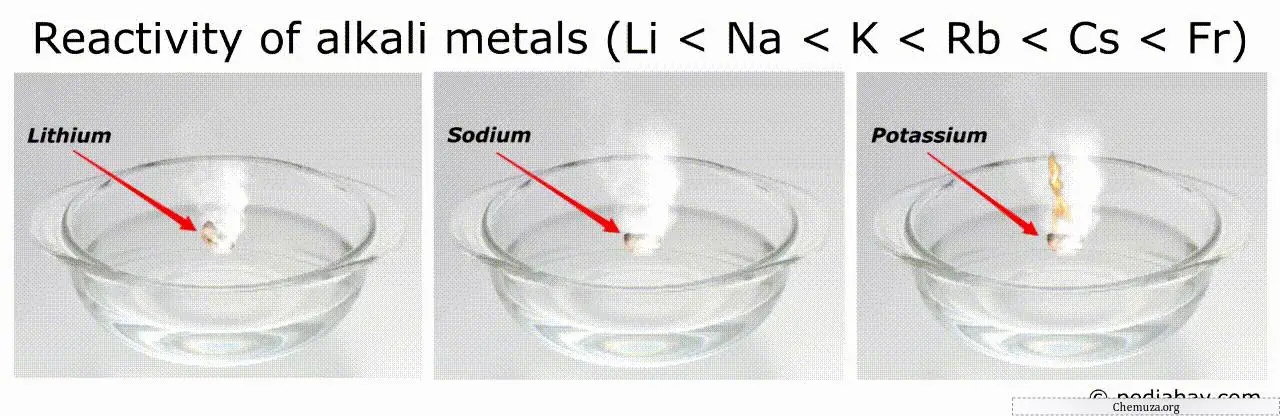
De algemene trend in de volgorde van de reactiviteit van alkalimetalen is dat deze toeneemt naarmate men lager in de groep komt van lithium (Li) naar frank (Fr).
Dit betekent dat frankium het meest reactieve van alle alkalimetalen is, terwijl lithium het minst reactieve is.
De reden voor deze trend is dat naarmate men lager in de groep komt, de atomaire straal van de elementen toeneemt, terwijl de ionisatie-energie afneemt.
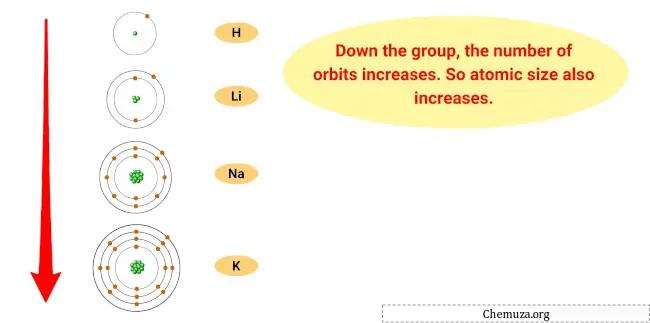
Dit betekent dat het buitenste elektron van de atomen verder van de kern verwijderd is en minder stevig vastgehouden wordt, waardoor het voor het element gemakkelijker wordt om dat elektron te verliezen en een kation te worden.
Francium, de grootste en minst verwante van de groep, is daarom het meest reactief.
Deze volgorde van reactiviteit heeft belangrijke implicaties voor de eigenschappen en het gedrag van alkalimetalen.
De meest reactieve metalen (zoals francium en cesium) kunnen bijvoorbeeld spontaan ontbranden in lucht of water, waardoor het zeer gevaarlijk is om ermee om te gaan.[3]
Omgekeerd zijn minder reactieve metalen (zoals lithium) stabieler en kunnen ze worden gebruikt in toepassingen die een stabieler metaal vereisen.
Lijst met alkalimetalen en hun elektronische configuraties
Alkalimetalen en hun elektronische configuraties worden hieronder weergegeven.
| Element | Elektronische configuratie |
| Lithium (Li) | [Het] 2s 1 |
| Natrium (Na) | [Doen] 3s 1 |
| Kalium (K) | [Ar] 4s 1 |
| Rubidium (Rb) | [Kr] 5s 1 |
| Cesium (Cs) | [Xe] 6s 1 |
| Frank (Fr) | [Rn] 7s 1 |
Periodieke trends in alkalimetalen
De periodieke trends van alkalimetalen worden hieronder vermeld:
- Valentietrend: De valentie van alkalimetalen is altijd +1, wat betekent dat ze de neiging hebben een elektron te verliezen om een stabiel kation te vormen. Er is daarom geen verandering in de valentie van de alkalimetalen naarmate men lager in de groep komt. Ze hebben allemaal dezelfde valentie (dwz 1).
- Trend in atoomgrootte: De atoomgrootte van alkalimetalen neemt toe naarmate je lager in de groep komt, wat betekent dat de atomen groter worden. Dit komt omdat naarmate je energieniveaus toevoegt, de omvang van de elektronenwolk toeneemt.
- Metaalkaraktertrend: Het metaalkarakter van alkalimetalen neemt toe naarmate u verder in de groep komt. Dit komt omdat metalen elektropositiever worden en beter in staat zijn elektronen te doneren om metaalbindingen te vormen.
- Elektronegativiteitstrend: De elektronegativiteit van alkalimetalen neemt af naarmate u lager in de groep komt. Dit komt omdat de atomen groter worden en de buitenste elektronen verder van de kern verwijderd zijn, waardoor ze er minder door aangetrokken worden.
- Elektronaffiniteitstrend: De elektronenaffiniteit van alkalimetalen neemt af naarmate u lager in de groep komt. Aan de onderkant van de groep neemt de omvang van de atomen inderdaad toe, waardoor de neiging van een atoom om het elektron te accepteren afneemt. (Lees hier meer over de trend van de elektronenaffiniteit, voor een gedetailleerd begrip).
- Trend ionisatie-energie: De ionisatie-energie van alkalimetalen neemt af naarmate u verder in de groep komt. Dit betekent dat het gemakkelijker is om een elektron uit de buitenste schil van het atoom te verwijderen, omdat de elektronen verder van de kern verwijderd zijn en minder stevig vastgehouden worden.
Samenvatting
Alkalimetalen zijn een groep chemische elementen die bekend staan om hun zachtheid, laag smeltpunt, hoge reactiviteit en vermogen om alkalische oplossingen te vormen bij reactie met water.
De volgorde van reactiviteit van alkalimetalen neemt toe naarmate je lager in de groep komt van lithium naar francium als gevolg van de toenemende atoomstraal en afnemende ionisatie-energie.
Periodieke trends in de alkalimetalen omvatten een toename van de atomaire grootte en het metallische karakter naarmate men lager in de groep komt, evenals een afname van de elektronegativiteit, elektronenaffiniteit en ionisatie-energie.
De valentie van alkalimetalen is altijd +1 en hun elektronische configuraties volgen een [edelgas] ns 1- model.
