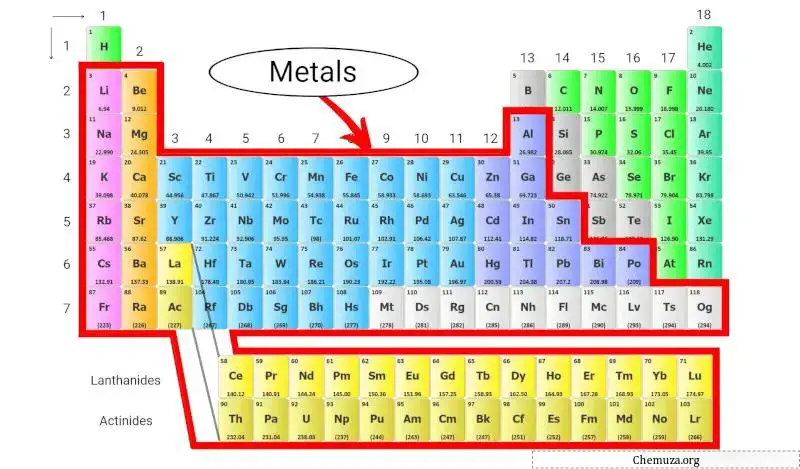
De metalen van het periodiek systeem zijn belangrijke elementen die we overal om ons heen aantreffen, van de munten in onze zakken tot de draden die onze huizen van stroom voorzien. In feite zijn de meeste elementen op het periodiek systeem metalen!
Ze hebben enkele gemeenschappelijke eigenschappen gemeen, zoals dat ze glanzend zijn, goede warmte- en elektriciteitsgeleiders zijn, en kneedbaar (wat betekent dat ze kunnen worden gebogen of gevormd zonder te breken). [1]
Laten we meer ontdekken over metalen en de verschillende soorten metalen die in het periodiek systeem voorkomen.
Wat zijn metalen precies?
Metalen zijn elementen die de neiging hebben elektronen te verliezen en kationen (positief geladen ionen) te vormen wanneer ze chemische reacties ondergaan.
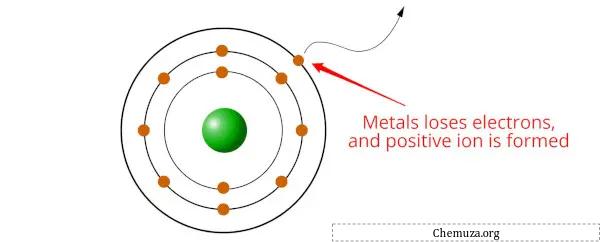
Maar weet je waarom dit gebeurt?
Dit komt omdat metalen lage ionisatie-energieën hebben, wat betekent dat er relatief weinig energie nodig is om een elektron uit een metaalatoom te verwijderen. Wanneer een metaalatoom één of meer elektronen verliest, wordt het een kation met een positieve lading.
Metalen hebben de neiging elektronen te verliezen om een stabielere elektronische configuratie te verkrijgen, meestal door een stabiel octet te verkrijgen (dat wil zeggen 8 elektronen in de buitenste schil).
Laten we nu eens kijken naar de verschillende soorten metalen die in het periodiek systeem zijn geclassificeerd.
Alkalimetalen
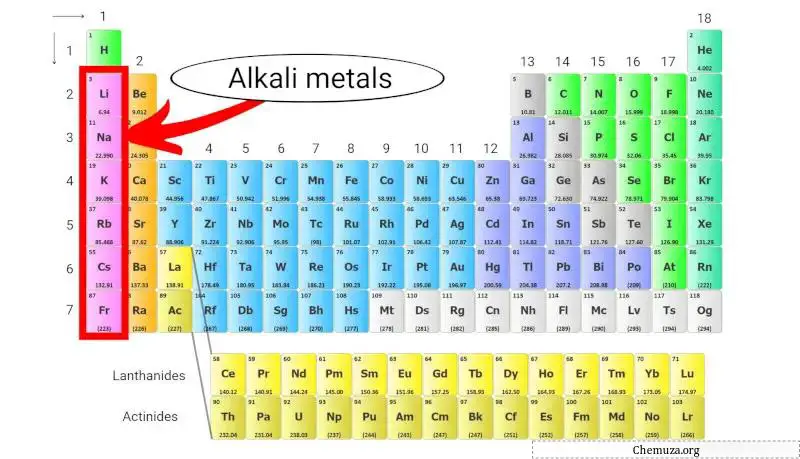
Alkalimetalen zijn een groep elementen in het periodiek systeem bestaande uit lithium (Li), natrium (Na), kalium (K), rubidium (Rb), cesium (Cs) en francium (Fr).
Ze behoren tot groep 1 van het periodiek systeem, ook wel bekend als de ‘alkalimetaalgroep’.
Alkalimetalen zijn zeer reactief vanwege hun lage ionisatie-energieën, waardoor de kans groter is dat ze hun enkele valentie-elektron verliezen om een kation met een +1 lading te vormen. [2]
Meer informatie over: Alkalimetalen van het periodiek systeem .
Aardalkalimetalen
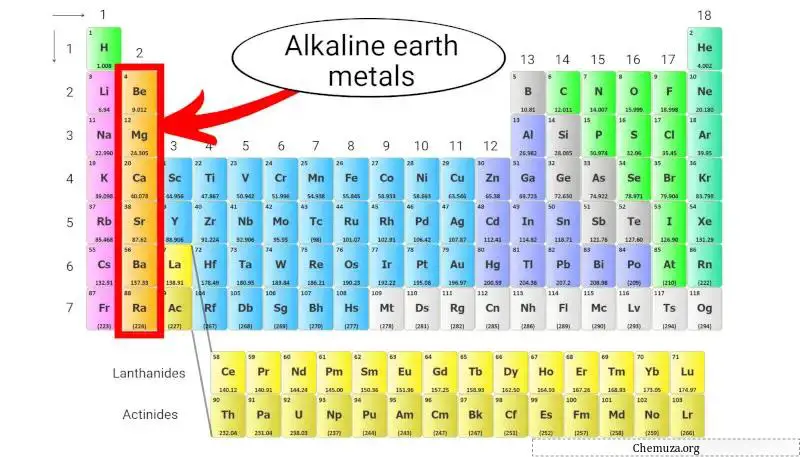
Aardalkalimetalen zijn een groep elementen in het periodiek systeem bestaande uit beryllium (Be), magnesium (Mg), calcium (Ca), strontium (Sr), barium (Ba) en radium (Ra).
Ze behoren tot groep 2 van het periodiek systeem, ook wel bekend als de ‘aardalkalimetaalgroep’.
Aardalkalimetalen zijn minder reactief dan alkalimetalen, maar hebben niettemin relatief lage ionisatie-energieën en hebben de neiging kationen te vormen met een lading van +2. [3]
Meer informatie over: Aardalkalimetalen van het periodiek systeem .
Overgangsmetalen
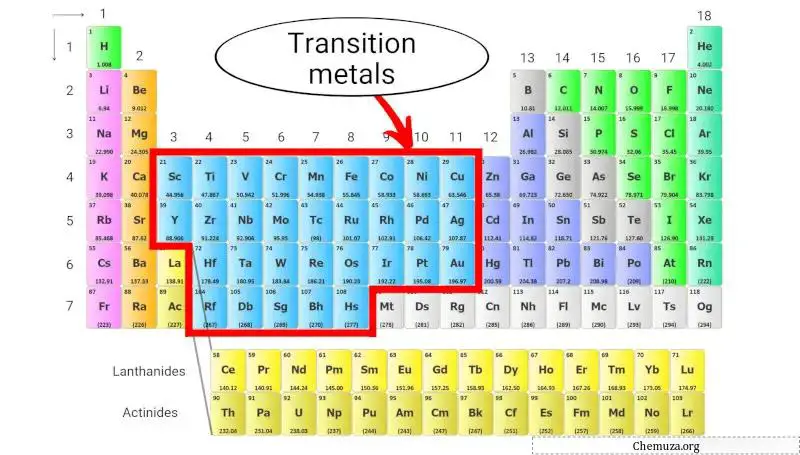
Overgangsmetalen zijn een groep metalen elementen die zich in het midden van het periodiek systeem bevinden en de groepen 3 tot en met 11 bezetten (zie afbeelding hierboven).
Ze worden gekenmerkt door hun vermogen om gekleurde verbindingen te vormen, hun meerdere oxidatietoestanden en hun relatief hoge dichtheden en smeltpunten.
Overgangsmetalen staan bekend om hun chemische reactiviteit, en vele daarvan worden gebruikt als katalysator bij chemische reacties. Ze worden ook gebruikt in verschillende toepassingen, zoals de productie van staal en andere legeringen, elektronica en batterijen.
Meer informatie over: Overgangsmetalen van het periodiek systeem .
Interne overgangsmetalen
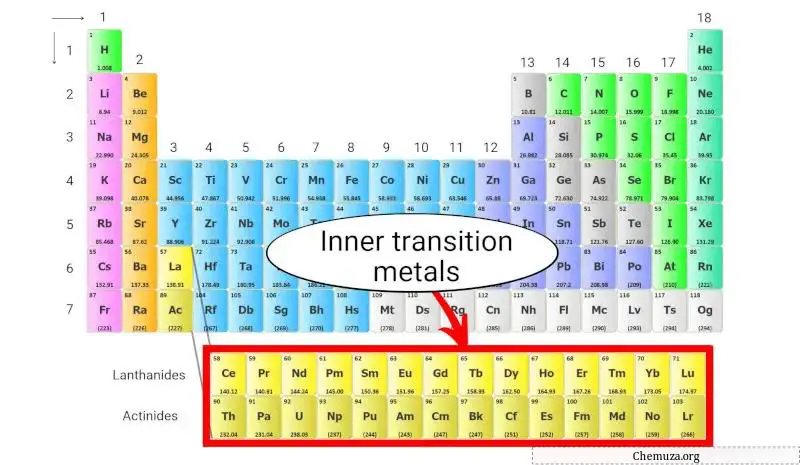
De interne overgangsmetalen zijn een groep metalen elementen die zich onderaan het periodiek systeem bevinden, onder het hoofdgedeelte van de tabel.
Ze zijn onderverdeeld in twee subgroepen:
- Lanthaniden en
- Actiniden.
De elektronische configuratie van interne overgangsmetalen is uniek, waarbij elektronen de f-orbitalen van hun atomen vullen. Dit resulteert in onderscheidende elektronische en magnetische eigenschappen, waardoor ze zeer bruikbaar zijn in verschillende technologische toepassingen.
Meer informatie over: Interne overgangsmetalen van het periodiek systeem .
Zeldzame aardmetalen
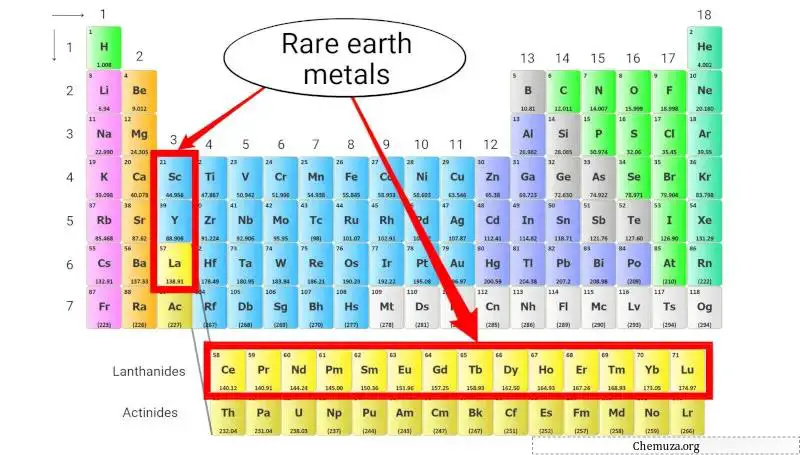
Zeldzame aardmetalen, ook wel zeldzame aardmetalen genoemd, zijn een groep metaalelementen die de lanthanidereeks (atoomnummers 57 tot 71), scandium (Sc) en yttrium (Y) omvatten.
Ondanks hun naam zijn zeldzame aardmetalen eigenlijk niet zeldzaam, maar ze zijn moeilijk en duur om uit ertsen te winnen vanwege hun lage concentraties en chemische overeenkomsten. [4]
Zware metalen
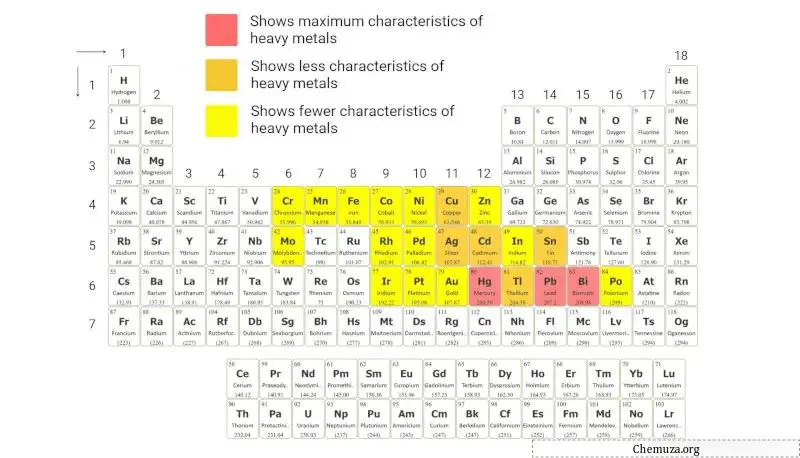
Zware metalen zijn een groep metalen elementen met een relatief hoge atomaire massa en dichtheid.
Zware metalen worden gewoonlijk geïdentificeerd aan de hand van het criterium van hun hoge dichtheid, doorgaans groter dan 5 g/cm³ .
Het periodiek systeem hierboven geeft een visuele weergave van deze elementen op basis van deze classificatie.
Meer informatie over: Zware metalen in het periodiek systeem .
Samenvatting
Metalen zijn elementen die de neiging hebben elektronen te verliezen en kationen te vormen wanneer ze chemische reacties ondergaan. Ze hebben een lage ionisatie-energie, waardoor de kans groter is dat ze elektronen verliezen en positief geladen ionen worden.
Het periodiek systeem bevat verschillende soorten metalen, waaronder alkalimetalen, aardalkalimetalen, overgangsmetalen, interne overgangsmetalen, zeldzame aardmetalen en zware metalen.
Alkalimetalen zijn zeer reactief, terwijl aardalkalimetalen minder reactief zijn. Overgangsmetalen staan bekend om hun vermogen om kleurrijke verbindingen en meerdere oxidatietoestanden te vormen, en interne overgangsmetalen bezitten unieke elektronische en magnetische eigenschappen. Zeldzame aardmetalen zijn moeilijk en duur te winnen, terwijl zware metalen een hoge dichtheid hebben.
