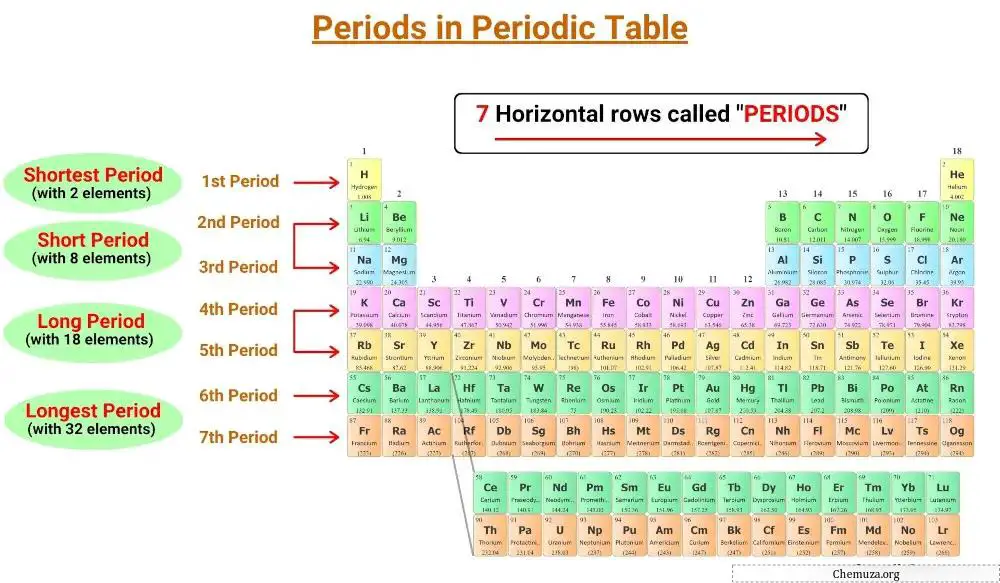
De horizontale lijnen van het periodiek systeem worden perioden genoemd en er zijn 7 perioden in het periodiek systeem.
Elementen die zich in dezelfde periode bevinden, hebben hetzelfde aantal elektronische lagen.
Laten we de perioden in het periodiek systeem verder onderzoeken.
Wat zijn perioden in het periodiek systeem?
In het periodiek systeem zijn punten de lijnen die zich horizontaal van links naar rechts uitstrekken.
Het periodiek systeem is zo georganiseerd dat elementen met vergelijkbare eigenschappen worden gegroepeerd in kolommen diegroepen of families worden genoemd, terwijl elementen uit dezelfde periode hetzelfde aantal elektronenschillen hebben.
Er zijn zeven perioden in het periodiek systeem, genummerd van 1 tot en met 7. [1]
Aantal schillen van een element en zijn periodenummer
Het aantal schillen van een element bepaalt de periode in het periodiek systeem.
Elementen uit periode 1 hebben bijvoorbeeld slechts één elektronenschil, terwijl elementen uit periode 2 twee elektronenschillen hebben, enzovoort.
Deze organisatie helpt scheikundigen de eigenschappen van een element te voorspellen op basis van zijn locatie in het periodiek systeem.
Kenmerken van elementen in perioden
Terwijl u door een periode van het periodiek systeem beweegt, veranderen verschillende kenmerken van de elementen op voorspelbare manieren. Dit komt door de periodieke trends die worden waargenomen in de eigenschappen van de elementen.
Atoomstraal:
Naarmate u gedurende een bepaalde periode van links naar rechts beweegt, neemt de atoomstraal doorgaans af. [2]
Dit komt doordat het aantal protonen in de kern toeneemt, waardoor er een grotere aantrekkingskracht ontstaat tussen de kern en de elektronen op het buitenste energieniveau. Dit resulteert in een kleinere atoomstraal.
Elektronegativiteit:
Elektronegativiteit is de maatstaf voor het vermogen van een atoom om elektronen naar zich toe te trekken in een chemische binding.
Naarmate u gedurende een bepaalde periode van links naar rechts beweegt, neemt de elektronegativiteit doorgaans toe. [3]
Dit komt omdat de atoomstraal kleiner is en de positieve lading van de kern sterker is, waardoor deze aantrekkelijker wordt voor negatief geladen elektronen.
Ionisatieenergie:
Ionisatie-energie is de hoeveelheid energie die nodig is om een elektron uit een atoom te verwijderen.
Naarmate u gedurende een bepaalde periode van links naar rechts beweegt, neemt de ionisatie-energie doorgaans toe. [4]
Dit komt omdat de atoomstraal kleiner is en de elektronen steviger door de kern worden vastgehouden, waardoor het moeilijker wordt om een elektron te verwijderen.
Andere mogelijkheden:
Smelt- en kookpunten: Over het algemeen stijgen ze in de loop van de tijd van links naar rechts, maar met enkele uitzonderingen.
Metallisch karakter: neemt af van links naar rechts in de loop van een periode, naarmate niet-metalen vaker voorkomen.
Reactiviteit: Elementen worden minder reactief als je gedurende een bepaalde periode van links naar rechts beweegt, omdat elektronen steviger worden vastgehouden en minder snel deelnemen aan chemische reacties.
Het belang van perioden in de chemie
De perioden van het periodiek systeem zijn essentieel voor het begrijpen van het gedrag van elementen, omdat ze informatie verschaffen over de elektronische configuratie van elementen en hoe ze omgaan met andere elementen. Hier zijn enkele redenen waarom menstruatie belangrijk is in de scheikunde:
- Eigenschappen voorspellen: Met het periodiek systeem kunnen wetenschappers de eigenschappen van elementen voorspellen op basis van hun positie in de tabel. Elementen uit dezelfde periode hebben bijvoorbeeld hetzelfde aantal elektronenschillen, wat kan helpen bij het voorspellen van hun atomaire grootte, reactiviteit en andere eigenschappen.
- Identificeer trends: Door de rangschikking van elementen in het periodiek systeem kunnen wetenschappers trends in hun eigenschappen identificeren. De elektronegativiteit en ionisatie-energie hebben bijvoorbeeld de neiging om in de loop van de tijd van links naar rechts toe te nemen, terwijl de atomaire grootte de neiging heeft af te nemen. Deze informatie kan worden gebruikt om voorspellingen te doen over hoe elementen zich gedragen in chemische reacties.
- Groepering van elementen: Het periodiek systeem groepeert elementen in categorieën op basis van hun eigenschappen, zoals metalen, niet-metalen en metalloïden . Dit helpt wetenschappers de overeenkomsten en verschillen tussen elementen te begrijpen en hoe ze met elkaar omgaan.
- Nieuwe elementen ontdekken: Het periodiek systeem helpt wetenschappers ook het bestaan en de eigenschappen van nieuwe elementen te voorspellen. Door gaten in de tabel te onderzoeken, kunnen wetenschappers de eigenschappen van onontdekte elementen voorspellen en deze in het laboratorium onderzoeken.
Samenvatting
Het periodiek systeem heeft zeven horizontale lijnen die perioden worden genoemd. Elementen uit dezelfde periode hebben hetzelfde aantal elektronische lagen. Er zijn zeven perioden in het periodiek systeem, genummerd van 1 tot en met 7, en het aantal schillen van een element bepaalt de periode ervan.
Naarmate je een periode van het periodiek systeem doorloopt, neemt de atoomstraal over het algemeen af, terwijl de elektronegativiteit en ionisatie-energie over het algemeen toenemen. Andere kenmerken zoals smelt- en kookpunten, metallisch karakter en reactiviteit veranderen ook voorspelbaar in de loop van de tijd.
De perioden van het periodiek systeem zijn belangrijk voor het voorspellen van de eigenschappen van elementen, het identificeren van trends, het groeperen van elementen en het ontdekken van nieuwe elementen. Door gaten in de tabel te onderzoeken, kunnen wetenschappers de eigenschappen van onontdekte elementen voorspellen en deze in het laboratorium onderzoeken.
