p-Tolueensulfonzuur is een sterk organisch zuur met een scherpe geur. Het wordt gebruikt als katalysator bij verschillende chemische reacties en als reagens bij organische synthese.
| IUPAC-naam | p-tolueensulfonzuur |
| Moleculaire formule | C7H8O3S |
| CAS-nummer | 104-15-4 |
| Synoniemen | PTSA, 4-methylbenzeensulfonzuur, p-tolueensulfonzuur |
| InChi | InChI=1S/C7H8O3S/c1-6-2-4-7(5-3-6)11(8,9)10/h2-5H,1H3,(H,8,9,10) |
Eigenschappen van p-tolueensulfonzuur
p-tolueensulfonzuurformule
De formule voor 4-methylbenzeensulfonzuur is C7H8O3S. Het vertegenwoordigt de moleculaire samenstelling van het zuur, bestaande uit zeven koolstofatomen, acht waterstofatomen, drie zuurstofatomen en één zwavelatoom.
p-tolueensulfonzuur Molaire massa
De molaire massa van 4-methylbenzeensulfonzuur wordt geschat op ongeveer 172,2 gram per mol. Molaire massa verwijst naar de massa van één mol van een stof, die wordt bepaald door de atoommassa’s van de samenstellende atomen op te tellen.
Kookpunt van p-tolueensulfonzuur
4-Methylbenzeensulfonzuur heeft een kookpunt van ongeveer 100 tot 110 graden Celsius. Het kookpunt vertegenwoordigt de temperatuur waarbij de vloeibare vorm van een stof verandert in een gas, waarbij de dampdruk gelijk is aan de atmosferische druk.
p-tolueensulfonzuur Smeltpunt
Het smeltpunt van 4-methylbenzeensulfonzuur ligt doorgaans tussen 105 en 107 graden Celsius. Het smeltpunt geeft de temperatuur aan waarbij een vaste stof onder normale atmosferische druk overgaat in een vloeibare toestand.
Dichtheid van p-tolueensulfonzuur g/ml
De dichtheid van 4-methylbenzeensulfonzuur is ongeveer 1,28 gram per milliliter (g/ml). Dichtheid verwijst naar de massa van een stof per volume-eenheid en wordt meestal uitgedrukt in gram per milliliter of gram per kubieke centimeter.
p-Tolueensulfonzuur Molecuulgewicht
Het molecuulgewicht van 4-methylbenzeensulfonzuur is ongeveer 172,2 gram per mol. Het vertegenwoordigt de som van de atoomgewichten van alle atomen in de molecuulformule van het zuur, en geeft de massa ervan op moleculaire schaal aan.
Structuur van p-tolueensulfonzuur
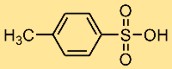
4-Methylbenzeensulfonzuur heeft een chemische structuur die bestaat uit een tolueenring met een functionele sulfonzuurgroep (-SO3H) bevestigd aan de para (p-) positie van de aromatische ring. Deze structuur zorgt voor zuurgraad en beïnvloedt de reactiviteit ervan in chemische reacties.
Oplosbaarheid van p-tolueensulfonzuur
4-Methylbenzeensulfonzuur is oplosbaar in water en in veel organische oplosmiddelen zoals ethanol en aceton. De oplosbaarheid in water komt voort uit de aanwezigheid van de polaire sulfonzuurgroep, die via waterstofbinding interageert met polaire watermoleculen.
| Verschijning | Wit tot gebroken wit kristallijn poeder |
| Soortelijk gewicht | 1,28 g/ml |
| Kleur | Kleurloos tot lichtgeel |
| Geur | Scherpe geur |
| Molaire massa | 172,2 g/mol |
| Dikte | 1,28 g/ml |
| Fusie punt | 105-107°C |
| Kookpunt | 100-110°C |
| Flitspunt | Niet beschikbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in ethanol, aceton en andere organische oplosmiddelen |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | ~ -2 |
| pH | < 1 |
Veiligheid en gevaren van p-tolueensulfonzuur
4-Methylbenzeensulfonzuur brengt bepaalde veiligheidsproblemen en gevaren met zich mee. Het is bijtend voor de huid, ogen en luchtwegen en veroorzaakt bij contact irritatie en brandwonden. Inademing van de dampen of het stof kan ademhalingsproblemen veroorzaken. Bij het hanteren ervan moeten beschermende maatregelen worden genomen, zoals handschoenen en een veiligheidsbril. Het moet worden bewaard in een goed gesloten container, uit de buurt van onverenigbare stoffen. Als inslikken of accidentele blootstelling plaatsvindt, is onmiddellijke medische aandacht vereist. Zuur moet worden gehanteerd in een goed geventileerde ruimte om de ophoping van gevaarlijke dampen te voorkomen. Over het algemeen zijn de juiste voorzorgsmaatregelen en het volgen van veiligheidsrichtlijnen essentieel om potentiële risico’s te minimaliseren.
| Gevarensymbolen | Bijtend |
| Beveiligingsbeschrijving | – Vermijd contact met de huid, ogen en luchtwegen. – Draag handschoenen, een veiligheidsbril en beschermende kleding. – Bewaren in een goed gesloten container, uit de buurt van onverenigbare stoffen. |
| Identificatiegegevens van de Verenigde Naties | Niet beschikbaar |
| HS-code | 29041000 |
| Gevarenklasse | 8 (Bijtende stof) |
| Verpakkingsgroep | III (Klein gevaar) |
| Toxiciteit | Bijtend en irriterend voor huid en ogen. Inademing van dampen of stof kan ademhalingsproblemen veroorzaken. |
Methoden voor de synthese van p-tolueensulfonzuur
Verschillende methoden maken de synthese van 4-methylbenzeensulfonzuur mogelijk. Een gebruikelijke aanpak omvat het laten reageren van tolueen met geconcentreerd zwavelzuur . De synthese van p-tolueensulfonzuur omvat het handhaven van een gecontroleerde temperatuur terwijl tolueen aan zwavelzuur wordt toegevoegd. De reactie produceert p-tolueensulfonzuur als het hoofdproduct.
Een andere methode omvat de oxidatie van de p-tolueensulfonzuurvoorloper, p-tolueensulfonylchloride, met behulp van een oxidatiemiddel zoals kaliumpermanganaat of natriumdichromaat . De reactie vindt plaats in een waterig of organisch oplosmiddel, resulterend in de vorming van p-tolueensulfonzuur.
Om p-tolueensulfonzuur te bereiden, kan rokend zwavelzuur (oleum) of zwaveltrioxide worden gebruikt om het tolueen te sulfoneren. Deze methode omvat de introductie van zwavelzuur of zwaveltrioxide in tolueen onder gecontroleerde omstandigheden, waarbij p-tolueensulfonzuur wordt geproduceerd.
Een katalysator, zoals een benzoylperoxide of ijzer(III)chloride, is aanwezig tijdens de reactie van tolueen met zwavelzuur om p-tolueensulfonzuur te synthetiseren. De katalysator vergemakkelijkt het sulfoneringsproces, wat leidt tot de vorming van p-tolueensulfonzuur.
Deze synthesemethoden maken de productie van p-tolueensulfonzuur mogelijk, dat toepassingen vindt in verschillende industrieën, waaronder farmaceutische producten, kleurstoffen en organische synthese. Het is belangrijk op te merken dat tijdens deze syntheseprocessen passende veiligheidsmaatregelen en juiste hanteringsprocedures moeten worden gevolgd.
Toepassingen van p-tolueensulfonzuur
4-Methylbenzeensulfonzuur heeft vele toepassingen in verschillende industrieën. Hier zijn enkele van de meest voorkomende toepassingen:
- Chemische reacties: 4-methylbenzeensulfonzuur katalyseert veresterings-, acylerings- en polymerisatiereacties.
- Organische synthese: Gebruik 4-methylbenzeensulfonzuur als reagens om functionele sulfonzuurgroepen in moleculen te introduceren, waardoor sulfonylerings- en desulfoneringsreacties bij organische synthese worden vergemakkelijkt.
- Farmaceutische producten: Pas 4-methylbenzeensulfonzuur toe bij de synthese van farmaceutische tussenproducten, waaronder antibiotica, analgetica en ontstekingsremmers.
- Kleurstofproductie: Gebruik 4-methylbenzeensulfonzuur bij de vervaardiging van kleurstoffen en pigmenten door aromatische verbindingen te sulfoneren om kleurstoffen te produceren.
- Galvaniseren: Gebruik 4-methylbenzeensulfonzuur als zure katalysator bij galvaniseerprocessen om metaalcoatings op verschillende oppervlakken af te zetten.
- Ionenuitwisselingsharsen: Gebruik 4-methylbenzeensulfonzuur bij de productie van ionenuitwisselingsharsen die worden gebruikt bij waterbehandeling, chromatografie en scheidingsprocessen.
- Polymeerindustrie: Toepassing van 4-methylbenzeensulfonzuur als polymerisatiekatalysator en stabilisator bij de productie van synthetische polymeren en kunststoffen.
- Oppervlaktebehandeling: Gebruik 4-methylbenzeensulfonzuur bij de oppervlaktebehandeling van metalen, zoals aluminium en staal, om hun corrosieweerstand en hechtingseigenschappen te verbeteren.
- Reinigingsmiddelen: Voeg 4-methylbenzeensulfonzuur toe als bestanddeel van reinigingsmiddelen en wasmiddelen om minerale afzettingen en roestvlekken te helpen verwijderen.
- Analytische Chemie: Gebruik 4-methylbenzeensulfonzuur als standaardstof voor kalibratiedoeleinden in verschillende analytische technieken, zoals hogedrukvloeistofchromatografie (HPLC).
Deze uiteenlopende toepassingen benadrukken de veelzijdigheid en het belang van 4-methylbenzeensulfonzuur in verschillende industriële processen en wetenschappelijke gebieden.
Vragen:
Vraag: Hoe reageren ethanol en p-tolueensulfonzuur met een carbonyl?
A: Ethanol en 4-methylbenzeensulfonzuur kunnen verestering ondergaan met een carbonyl, wat resulteert in de vorming van een ester.
Vraag: Waar wordt p-tolueensulfonzuur voor gebruikt?
Een 4-methylbenzeensulfonzuur vindt toepassingen als katalysator, reagens bij de organische synthese, bij de productie van kleurstoffen, bij de farmaceutische synthese en bij de oppervlaktebehandeling van metalen.
Vraag: Is pyridinium-p-tolueensulfonaat een zuur?
A: Ja, pyridinium-p-tolueensulfonaat is een zuur, met name een derivaat van pyridinesulfonzuur.
Vraag: Is p-tolueensulfonzuur anorganisch?
A: Nee, 4-methylbenzeensulfonzuur is een organische verbinding die koolstof-, waterstof-, zuurstof- en zwavelatomen bevat.
Vraag: Wat is het mechanisme van p-tolueensulfonzuur en alcohol?
A: Het mechanisme omvat de protonering van de alcohol door 4-methylbenzeensulfonzuur, gevolgd door het vertrek van een watermolecuul, resulterend in de vorming van een alkyl-p-tolueensulfonaat.
Vraag: Teken de organische producten van de volgende reactie: p-tolueensulfonzuur.
A: De organische producten zijn afhankelijk van de specifieke reactieomstandigheden en de betrokken reagentia, aangezien 4-methylbenzeensulfonzuur aan een verscheidenheid aan reacties kan deelnemen.
Vraag: Wat zijn p-tolueensulfonzuurreacties?
A: 4-Methylbenzeensulfonzuur kan reacties ondergaan zoals verestering, sulfonering, desulfonering en substitutiereacties met verschillende organische verbindingen.
Vraag: Is p-tolueensulfonzuur een organische base?
A: Nee, 4-methylbenzeensulfonzuur is geen organische base maar eerder een organisch zuur vanwege de aanwezigheid van een sulfonzuurgroep.
Vraag: Hoe maak je een alkeen met p-tolueensulfonzuur?
A: 4-Methylbenzeensulfonzuur alleen zet een verbinding niet direct om in een alkeen. Het kan echter worden gebruikt als katalysator of reagens bij specifieke reacties die leiden tot de vorming van alkenen, zoals dehydratatie- of eliminatiereacties.
