Oxaalzuur is een kleurloze en geurloze organische verbinding die in veel groenten en fruit voorkomt. Het wordt gebruikt in verschillende industriële processen, zoals het reinigen en polijsten van metaal. Het kan ook schadelijk zijn als het in grote hoeveelheden wordt ingenomen.
| IUPAC-naam | Ethaandizuur |
| Moleculaire formule | C2H2O4 |
| CAS-nummer | 144-62-7 |
| Synoniemen | Ethaandizuur, suikerzuur, oxirinezuur, houtbleekmiddel, zuringzuur, C2dicarbonzuur, enz. |
| InChi | InChI=1S/C2H2O4/c3-1(4)2(5)6/h(H,3,4)(H,5,6) |
Eigenschappen van oxaalzuur
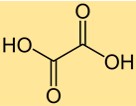
Oxaalzuurformule
De chemische formule voor oxaalzuur is C2H2O4. Het bestaat uit twee koolstofatomen, twee zuurstofatomen en vier waterstofatomen. De formule voor oxaalzuur is belangrijk bij veel chemische berekeningen, zoals het bepalen van het molecuulgewicht of het aantal mol oxaalzuur in een monster. De formule geeft ook informatie over de verhouding van de atomen die in het molecuul aanwezig zijn.
Molaire massa van oxaalzuur
De molaire massa van ethaandizuur is 90,03 g/mol. Dit wordt berekend door de atoommassa’s van elk element in het molecuul op te tellen (2 koolstofatomen, 2 zuurstofatomen en 4 waterstofatomen). De molaire massa van ethaandizuur is belangrijk bij veel chemische berekeningen, zoals het bepalen van de hoeveelheid ethaandizuur die nodig is voor een specifieke reactie of de concentratie van een ethaandizuuroplossing.
Kookpunt van oxaalzuur
Het kookpunt van ethaandizuur is 365°C. Bij deze temperatuur verandert de vloeibare fase van ethaandizuur in de dampfase en wordt een gas. Het kookpunt van ethaandizuur wordt beïnvloed door verschillende factoren zoals druk, zuiverheid en de aanwezigheid van onzuiverheden. Oxaalzuur is relatief stabiel bij hoge temperaturen, maar langdurige blootstelling aan hitte kan ervoor zorgen dat het ontbindt en kooldioxide en water produceert.
Smeltpunt van oxaalzuur
Het smeltpunt van ethaandizuur is 189-191°C. Dit is de temperatuur waarbij vast ethaandizuur vloeibaar begint te worden en vloeibaar wordt. Het smeltpunt van ethaandizuur kan worden beïnvloed door verschillende factoren, zoals zuiverheid, druk en kristalstructuur. Smeltpunt is een belangrijke fysische eigenschap van ethaandizuur omdat het helpt bij het bepalen van de geschiktheid ervan voor verschillende toepassingen.
Dichtheid van oxaalzuur g/ml
De dichtheid van ethaandizuur is 1,90 g/ml. Dit betekent dat één milliliter ethaandizuur 1,90 gram weegt. De dichtheid van ethaandizuur kan variëren afhankelijk van de temperatuur, druk en concentratie van de oplossing. De dichtheid van ethaandizuur is een belangrijke eigenschap die in veel chemische en industriële processen wordt gebruikt, zoals het bepalen van de hoeveelheid ethaandizuur die nodig is voor een reactie of het berekenen van het volume van een oplossing.
Oxaalzuur Molecuulgewicht
Het molecuulgewicht van ethaandizuur is 90,03 g/mol. Het is de som van de atoomgewichten van alle atomen in het molecuul. Het molecuulgewicht van ethaandizuur wordt gebruikt bij verschillende chemische berekeningen, zoals het bepalen van het aantal mol ethaandizuur in een bepaald monster of de concentratie van een ethaandizuuroplossing.
Structuur van oxaalzuur
Oxaalzuur heeft een dicarbonzuurstructuur, met twee carboxylgroepen (-COOH) gebonden aan een centraal koolstofatoom. Het molecuul heeft een vlakke structuur, waarbij de twee carboxylgroepen loodrecht georiënteerd zijn. De structuur van oxaalzuur maakt het tot een sterk organisch zuur dat in een oplossing twee protonen kan doneren.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 1,90 g/ml bij 20°C |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 90,03 g/mol |
| Dikte | 1,90 g/ml bij 20°C |
| Fusie punt | 189-191°C |
| Kookpunt | 365°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 90 g/l bij 20°C |
| Oplosbaarheid | Oplosbaar in water, alcohol, ether en glycerol |
| Dampdruk | 0,0001 mmHg bij 25°C |
| Dampdichtheid | 3,3 (lucht=1) |
| pKa | pKa1=1,25, pKa2=4,14 |
| pH | 1,2 (0,1M oplossing) |
Veiligheid en gevaren van oxaalzuur
Oxaalzuur is een gevaarlijke stof die schadelijk kan zijn als er niet op de juiste manier mee wordt omgegaan. Het kan bijtend zijn voor de huid, ogen en luchtwegen en bij contact irritatie of brandwonden veroorzaken. Inademing van ethaandizuurstof of damp kan ook irritatie van de luchtwegen en longschade veroorzaken. Bij het hanteren van ethaandizuur is het belangrijk om geschikte persoonlijke beschermingsmiddelen te dragen, zoals handschoenen, een veiligheidsbril en een gasmasker. Bovendien moet het op een koele, droge plaats worden bewaard, uit de buurt van hitte- en ontstekingsbronnen. Verwijdering van ethaandizuur moet worden uitgevoerd in overeenstemming met de plaatselijke regelgeving.
| Gevarensymbolen | T, C |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. Draag geschikte beschermende kleding, handschoenen en oog-/gezichtsbescherming. Bij contact met de ogen onmiddellijk met veel water afspoelen en een arts raadplegen. Bij een ongeval of als u zich onwel voelt, dient u onmiddellijk medische hulp in te roepen (indien mogelijk het etiket tonen). |
| AN-identificaties | UN3261 |
| HS-code | 291711 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | III |
| Toxiciteit | Oraal LD50: 750 mg/kg (rat), dermaal LD50: 1000 mg/kg (konijn), inhalatie LC50: 1100 ppm/8u (rat) |
Methoden voor synthese van oxaalzuur
Er zijn verschillende methoden voor het synthetiseren van oxaalzuur (ethaandizuur), waaronder de oxidatie van koolhydraten, de oxidatie van ethyleenglycol en de reactie van koolmonoxide met natriumhydroxide .
Een van de meest gebruikelijke methoden is het oxideren van koolhydraten met behulp van salpeterzuur. Door hydrolyse van koolhydraten ontstaan monosachariden, die we vervolgens oxideren met behulp van salpeterzuur en een katalysator zoals vanadiumpentoxide. Nadat we het resulterende mengsel met calciumcarbonaat hebben behandeld, behandelen we het met zwavelzuur, waarbij ethaandizuur vrijkomt.
Een andere methode voor het synthetiseren van ethaandizuur is de oxidatie van ethyleenglycol met behulp van salpeterzuur en een katalysator zoals platina of palladium. We oxideren ethyleenglycol tot glycolzuur en oxideren het vervolgens verder tot ethaandizuur met behulp van salpeterzuur en een katalysator. Vervolgens behandelen we het resulterende mengsel met calciumcarbonaat en zwavelzuur om ethaandizuur vrij te maken.
Een derde methode voor het synthetiseren van ethaandizuur omvat de reactie van koolmonoxide met natriumhydroxide in aanwezigheid van een katalysator zoals nikkel of kobalt. De reactie van koolmonoxide met natriumhydroxide produceert natriumformiaat, dat we vervolgens laten reageren met natriumhydroxide om natriumoxalaat te produceren. Bij behandeling van natriumoxalaat met zwavelzuur komt ethaandizuur vrij.
Gebruik van oxaalzuur
Oxaalzuur heeft veel verschillende toepassingen in verschillende industrieën vanwege zijn unieke chemische eigenschappen. Hier zijn enkele veelvoorkomende toepassingen van ethaandizuur:
- Roestverwijdering: Vaak gebruikt als roestverwijderaar voor metalen oppervlakken, waaronder ijzer, staal en koper.
- Bleekmiddel: Gebruikt in de textielindustrie om stoffen en vezels witter te maken.
- Houtbewerking: Wordt gebruikt om vlekken uit hout te verwijderen, zoals watervlekken of vlekken veroorzaakt door ijzer of andere metalen.
- Reinigingsmiddel: Gebruikt als reinigingsmiddel voor verschillende oppervlakken, waaronder badkamer- en keukenarmaturen, werkbladen en vloeren.
- Chelaatvormer: Wordt ook gebruikt als chelaatvormer in verschillende industriële processen, waaronder de productie van keramiek en farmaceutische producten.
- Etsmiddel: Gebruikt als etsmiddel in de elektronica-industrie om metaaloxiden en onzuiverheden van halfgeleideroppervlakken te verwijderen.
- Fotografie: Gebruikt in de fotografie als ontwikkelaar voor bepaalde soorten fotografische films.
- Medisch gebruik: Gebruikt bij sommige medische behandelingen, waaronder het verwijderen van calciumafzettingen uit het lichaam en het behandelen van urineweginfecties.
Vragen:
Vraag: Waar kan ik oxaalzuur bij mij in de buurt kopen?
A: Oxaalzuur kan bij veel bouwmarkten, bouwmarkten en online winkels worden gekocht. Het is mogelijk ook verkrijgbaar bij speciaalzaken voor chemische artikelen.
Vraag: Hoe kan ik oxaalzuur in voedsel neutraliseren?
A: Oxaalzuur kan in voedingsmiddelen worden geneutraliseerd door een calciumrijke substantie toe te voegen, zoals melk of kaas. Calcium zal zich binden aan oxaalzuur, waardoor het effect op het lichaam wordt verminderd.
Vraag: Wat is het massapercentage koolstof in oxaalzuur, H2C2O4?
A: Het molecuulgewicht van oxaalzuur is 90,03 g/mol. De massa koolstof in één mol ethaandizuur is 24,02 g. Daarom is het massapercentage koolstof in ethaandizuur (24,02 g/90,03 g) x 100% = 26,66%.
Vraag: Hoe kan ik oxaalzuur in spinazie verminderen?
A: Oxaalzuur kan in spinazie worden verminderd door de spinazie te blancheren voordat u deze consumeert. Dit proces omvat het kort koken van spinazie en het vervolgens afkoelen in ijswater om het ethaandizuurgehalte te verlagen.
Vraag: Wat is het massapercentage koolstof in oxaalzuur, H2C2O4?
A: Het molecuulgewicht van oxaalzuur is 90,03 g/mol. De massa koolstof in één mol ethaandizuur is 24,02 g. Daarom is het massapercentage koolstof in ethaandizuur (24,02 g/90,03 g) x 100% = 26,66%.
Vraag: Is H2C2O4 een zuur of een base?
A: H2C2O4 is een zuur, ook bekend als ethaandizuur.
Vraag: Wat is de reactievolgorde van H2C2O4? A: De reactievolgorde van H2C2O4 hangt af van de specifieke reactie in kwestie. Het kan experimenteel worden bepaald met behulp van methoden zoals de initiële tariefmethode of geïntegreerde tariefwetten.
