Calciumoxide, ook wel ongebluste kalk genoemd, is een witte, alkalische substantie met een hoog smeltpunt. Het reageert krachtig met water om calciumhydroxide te produceren en genereert aanzienlijke warmte. Het wordt gebruikt in diverse industriële toepassingen, waaronder cementproductie, landbouw en waterzuivering.
| IUPAC-naam | Calcium oxide |
| Moleculaire formule | CaO |
| CAS-nummer | 1305-78-8 |
| Synoniemen | Ongebluste kalk; Verbrande kalk; Limoen; Calx; Ongebluste kalk; Calcium(II)oxide; Calcia; Kalksteen; Kalksteenrots; Calciummonoxide; Fondant limoen |
| InChi | InChI=1S/Ca.O |
Eigenschappen van calciumoxide
Calciumoxide-formule
De chemische formule voor calciumoxide is CaO, wat aangeeft dat het een calciumkation (Ca2+) en een oxide-anion (O2-) bevat. De formule van calciumoxide weerspiegelt de ionische aard ervan, waarbij calciumkationen en oxide-anionen bij elkaar worden gehouden door sterke elektrostatische krachten. De calciumoxideformule wordt gebruikt om de verbinding in verschillende chemische reacties te identificeren en om het molecuulgewicht en andere fysische eigenschappen ervan te berekenen.
Molaire massa calciumoxide
De molaire massa van calciumoxide, ook wel ongebluste kalk genoemd, is 56.077 gram per mol. Het wordt afgeleid van het atoomgewicht van het calcium (40,078 g/mol) en de zuurstof (15,999 g/mol) waaruit de verbinding bestaat. De molaire massa van calciumoxide wordt gebruikt bij verschillende berekeningen, zoals het bepalen van de hoeveelheid reactant die nodig is om een specifieke hoeveelheid product te produceren of het berekenen van de concentratie van een oplossing.
Kookpunt van calciumoxide
Calciumoxide heeft geen kookpunt omdat het bij hoge temperaturen thermische ontleding ondergaat in plaats van te koken. Bij temperaturen boven 2572°C valt calciumoxide uiteen in calcium en zuurstof. Thermische ontleding van calciumoxide kan echter worden gebruikt om calciumoxide met een hogere zuiverheid en reactiviteit voor industriële toepassingen te produceren.
Smeltpunt van calciumoxide
Het smeltpunt van calciumoxide is 2572°C, waardoor het een stof met een hoog smeltpunt is. Het heeft een hoog smeltpunt vanwege zijn ionische aard, waarbij calciumkationen en oxide-anionen bij elkaar worden gehouden door sterke elektrostatische krachten. Het hoge smeltpunt van calciumoxide maakt het ook bruikbaar in toepassingen bij hoge temperaturen, zoals de productie van staal en cement.
Dichtheid van calciumoxide g/ml
De dichtheid van calciumoxide varieert afhankelijk van de kristalstructuur en zuiverheid. De typische dichtheid van calciumoxide is 3,35 g/ml voor bulkmateriaal, terwijl de theoretische dichtheid 3,50 g/ml is. De lage dichtheid van calciumoxide is te danken aan de poreuze structuur, waardoor het vocht uit de lucht kan opnemen en het gewicht en volume kan vergroten.
Molecuulgewicht van calciumoxide
Het molecuulgewicht van calciumoxide, ook wel formulegewicht of molmassa genoemd, is 56,077 gram per mol. Het wordt berekend door de atoomgewichten van het calcium en de zuurstof waaruit de verbinding bestaat op te tellen. Het molecuulgewicht van calciumoxide wordt gebruikt bij verschillende berekeningen, zoals het bepalen van de hoeveelheid reactant die nodig is om een specifieke hoeveelheid product te produceren of het berekenen van de concentratie van een oplossing.
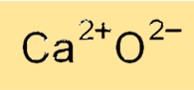
Structuur van calciumoxide
Calciumoxide heeft een kubische kristalstructuur, waarbij de calciumkationen en oxide-anionen zijn gerangschikt in een kubisch rooster met het gezicht in het midden. De kristalstructuur van calciumoxide is vergelijkbaar met die van natriumchloride en andere ionische verbindingen. De ionische aard van calciumoxide maakt het tot een goede elektrische isolator en een belangrijk materiaal bij de vervaardiging van elektronische componenten.
| Verschijning | Witte, geurloze vaste stof |
| Soortelijk gewicht | 3,35 g/cm³ |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 56,077 g/mol |
| Dikte | 3,35 g/cm³ |
| Fusie punt | 2572°C |
| Kookpunt | Kookt niet, ondergaat thermische ontleding |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Reageert met water en vormt calciumhydroxide |
| Oplosbaarheid | Onoplosbaar in water, oplosbaar in zuur |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | 12-13 |
Veiligheid en gevaren van calciumoxide
Calciumoxide, ook bekend als ongebluste kalk, is een zeer reactieve en bijtende stof die verschillende gevaren met zich meebrengt voor de menselijke gezondheid en het milieu. Als het niet op de juiste manier wordt behandeld, kan het ernstige irritatie en brandwonden aan de huid, ogen en luchtwegen veroorzaken. Inademing van ongebluste kalkstof of damp kan ademhalingsproblemen, hoesten en kortademigheid veroorzaken. Het is ook zeer reactief met water en kan grote hoeveelheden warmte vrijgeven, wat brandwonden en stoomexplosies tot gevolg kan hebben. Ongebluste kalk moet worden bewaard in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare stoffen. De juiste beschermende uitrusting en hanteringsprocedures moeten worden gevolgd om ongelukken en blootstelling te voorkomen.
| Gevarensymbolen | Corrosief (C) |
| Beveiligingsbeschrijving | Draag handschoenen, kleding en oog-/gezichtsbescherming. Zorgvuldig behandelen en bewaren. Vermijd inademing, inslikken en contact met huid en ogen. |
| VN-identificatienummers | VN1910 |
| HS-code | 2522.20.00 |
| Gevarenklasse | 8 – Bijtende stoffen |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig |
Synthesemethoden voor calciumoxide
De thermische ontleding van kalksteen, de reactie van calciumhydroxide met warmte en de elektrolyse van calciumchloride synthetiseren calciumoxide of ongebluste kalk.
De meest gebruikelijke methode voor het synthetiseren van ongebluste kalk is het verwarmen van de kalk tot een hoge temperatuur van ongeveer 900 tot 1000 °C in een kalkoven. Bij dit proces, bekend als calcineren, komt kooldioxide vrij en blijft ongebluste kalk achter. Door het verwerken en malen van ongebluste kalk ontstaat een fijn poeder voor meerdere toepassingen.
Een andere methode om ongebluste kalk te synthetiseren is het verwarmen van calciumhydroxide, ook wel gebluste kalk genoemd, tot een hoge temperatuur. Bij dit proces, bekend als dehydroxylering, komt ook water vrij en blijft ongebluste kalk achter.
Calciumchloride- elektrolyse is een minder gebruikelijke methode voor het synthetiseren van ongebluste kalk. Los calciumchloride op in water en laat een elektrische stroom door de oplossing lopen om ongebluste kalk en chloorgas te genereren.
Gebruik van calciumoxide
Calciumoxide, ook wel ongebluste kalk genoemd, heeft vanwege zijn unieke eigenschappen vele toepassingen in verschillende industrieën. Enkele van de belangrijkste toepassingen zijn:
- Staalproductie: Gebruikt als vloeimiddel bij de staalproductie, waar het helpt onzuiverheden te verwijderen en de kwaliteit van staal te verbeteren.
- Waterbehandeling: Gebruikt bij waterbehandeling om onzuiverheden te verwijderen en de pH van water aan te passen.
- Landbouw: Gebruikt in de landbouw als bodemverbetering om de pH van de bodem aan te passen en essentiële voedingsstoffen aan planten te leveren.
- Chemische industrie: gebruikt bij de productie van chemicaliën zoals calciumcarbide, calciumhypochloriet en calciumstearaat.
- Constructie: Gebruikt in de bouwsector als bestanddeel van cement, mortel en gips.
- Voedingsindustrie: Gebruikt in de voedingsindustrie als verstevigingsmiddel en zuurteregelaar.
- Papierindustrie: Gebruikt in de papierindustrie als onderdeel van witte vloeistof die wordt gebruikt bij het kraftpulpproces.
- Aardolie-industrie: Gebruikt in de aardolie-industrie als katalysator bij het raffinageproces.
Vragen:
Vraag: Wat is de formule voor calciumoxide?
A: De formule voor calciumoxide is CaO.
Vraag: Wat is het oxidatiegetal van calcium?
A: Het oxidatiegetal van calcium in calciumoxide is +2.
Vraag: Is calciumoxide ionisch of covalent?
A: Calciumoxide is een ionische verbinding die bestaat uit positief geladen calciumionen en negatief geladen oxide-ionen.
Vraag: Is calciumoxide een vaste stof?
A: Ja, calciumoxide is een vaste stof bij standaard kamertemperatuur en druk. Het heeft een wit of grijsachtig wit uiterlijk en is zeer reactief.
