Octaan is een brandstof met een hoog octaangehalte die wordt gebruikt in verbrandingsmotoren. Het verbetert de motorprestaties, vermindert kloppen en verhoogt het vermogen. Het wordt vaak gebruikt in krachtige voertuigen en raceauto’s.
| IUPAC-naam | Octaan |
| Moleculaire formule | C8H18 |
| CAS-nummer | 111-65-9 |
| Synoniemen | n-Octaan, Normaal Octaan, Octaan |
| InChi | InChI=1S/C8H18/c1-3-5-7-8-6-4-2/h3-8H2.1-2H3 |
Octaan eigenschappen
Octaan-formule
De formule voor octaan is C8H18. Het bestaat uit acht koolstofatomen en achttien waterstofatomen. Deze molecuulformule vertegenwoordigt de rangschikking van atomen in een enkel octaanmolecuul.
Octaan molaire massa
De molaire massa van octaan wordt berekend door de atoommassa’s van alle atomen in de chemische formule op te tellen. De molaire massa van octaan is ongeveer 114,22 gram per mol. Dit is belangrijk bij verschillende berekeningen met betrekking tot de hoeveelheid octaan in een bepaald monster.
Kookpunt van octaangetal
Octan heeft een kookpunt van ongeveer 125,5 graden Celsius (257,9 graden Fahrenheit). Dit is de temperatuur waarbij octaan overgaat van een vloeibare fase naar een gasfase. Het kookpunt van octaan wordt beïnvloed door de moleculaire structuur en intermoleculaire krachten.
Smeltpunt van octaan
Octan heeft een smeltpunt van ongeveer -57 graden Celsius (-70,6 graden Fahrenheit). Dit is de temperatuur waarbij octaan verandert van vast naar vloeibaar. Het smeltpunt van octaan hangt af van factoren zoals de moleculaire structuur en intermoleculaire krachten.
Octaandichtheid g/ml
De dichtheid van octaan is ongeveer 0,703 gram per milliliter (g/ml). Dichtheid is een maat voor de massa per volume-eenheid van een stof. De dichtheid van octaan is lager dan die van water, dat een dichtheid heeft van 1 g/ml, wat aangeeft dat octaan een lagere dichtheid heeft dan water.
Octaan molecuulgewicht
Het molecuulgewicht van octaan is ongeveer 114,22 gram per mol. Het is de som van de atoomgewichten van alle atomen in een octaanmolecuul. Het molecuulgewicht is cruciaal bij verschillende berekeningen, zoals het bepalen van de hoeveelheid octaan die nodig is voor een reactie.
Octaan structuur
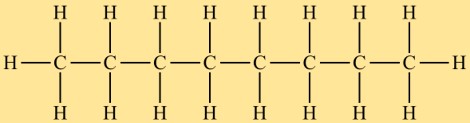
Octan behoort tot de alkaanklasse en heeft een lineaire structuur. Het bestaat uit een keten van acht koolstofatomen waaraan waterstofatomen zijn bevestigd. De rangschikking van atomen in octaan is zodanig dat er geen vertakte of cyclische structuur is.
Oplosbaarheid van het octaangetal
Octan wordt als onoplosbaar in water beschouwd. Het vertoont een lage oplosbaarheid in polaire oplosmiddelen vanwege zijn niet-polaire aard. Octaan is echter zeer oplosbaar in niet-polaire oplosmiddelen, zoals andere koolwaterstoffen, oliën en organische oplosmiddelen.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 0,703 g/ml |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 114,22 g/mol |
| Dikte | 0,703 g/ml |
| Fusie punt | -57°C (-70,6°F) |
| Kookpunt | 125,5°C (257,9°F) |
| Flitspunt | -18°C (0°F) |
| oplosbaarheid in water | Onoplosbaar |
| Oplosbaarheid | Oplosbaar in niet-polaire oplosmiddelen |
| Dampdruk | 12,9 mmHg bij 20°C |
| Dampdichtheid | 3,47 (lucht = 1) |
| pKa | ~45 |
| pH | Neutrale |
Octane-veiligheid en gevaren
Octan brengt bepaalde veiligheidsrisico’s met zich mee waarmee rekening moet worden gehouden. Het is licht ontvlambaar en kan gemakkelijk ontbranden, waardoor brandgevaar ontstaat. Octandampen kunnen met lucht explosieve mengsels vormen, waardoor het risico op brand en explosies toeneemt. Het is belangrijk om voorzichtig met Octan om te gaan, voor voldoende ventilatie te zorgen en ontstekingsbronnen te vermijden. Huidcontact met octan kan irritatie en uitdroging veroorzaken. Inslikken of inademen van octan kan gezondheidsrisico’s veroorzaken, waaronder irritatie van de luchtwegen en effecten op het centrale zenuwstelsel. Het is essentieel om veiligheidsmaatregelen te volgen, geschikte persoonlijke beschermingsmiddelen te gebruiken en Octan uit de buurt te houden van onverenigbare stoffen.
| Gevarensymbolen | Ontvlambaar (F), Irriterend (Xi) |
| Beveiligingsbeschrijving | Verwijderd houden van hitte/vonken/open vuur. Gebruik in een goed geventileerde ruimte. Vermijd contact met huid en ogen. |
| VN-identificatienummers | VN 1262 |
| HS-code | 2901.10.10 |
| Gevarenklasse | 3 – Ontvlambare vloeistoffen |
| Verpakkingsgroep | III |
| Toxiciteit | Zwak |
Octaansynthesemethoden
Verschillende methoden kunnen octaan synthetiseren. Een gebruikelijke methode is het katalytisch hervormen van aardoliefracties zoals nafta. Het proces verwarmt de nafta en voert deze over een katalysator, meestal platina of renium, waardoor de herschikking van de koolwaterstofmoleculen wordt bevorderd. Deze herschikking produceert verbindingen met een hoger octaangehalte, met name octaan.
Een andere methode is het alkyleren van isobutaan met butenen. Zwavelzuur of fluorwaterstofzuur , dat werkt als zure katalysatoren, vergemakkelijkt de reactie van isobutaan, een vertakte koolwaterstof, met onverzadigde koolwaterstoffen (butenen). Deze reactie vormt octaanmoleculen met vertakte keten.
Isomerisatie is een aanvullende benadering om octaan te produceren. Het zet koolwaterstoffen met een rechte keten, zoals hexaan of heptaan, om in isomeren met een vertakte keten. Verschillende katalysatoren, waaronder zeolieten of platinakatalysatoren, kunnen dit proces katalyseren.
Bovendien kan octaan worden verkregen door aromatische koolwaterstoffen zoals tolueen of xyleen te hydrogeneren met behulp van waterstofgas en een geschikte katalysator. Deze reactie zet aromatische verbindingen om in cyclohexaan, dat verder kan worden gedehydrogeneerd om octaan te produceren.
Deze synthesemethoden spelen een belangrijke rol bij de productie van octaan, dat veel wordt gebruikt als brandstofcomponent in benzine. Met behulp van deze technieken kan een octaan met het gewenste octaangetal worden verkregen, waardoor optimale prestaties en efficiëntie in verbrandingsmotoren worden gegarandeerd.
Gebruik van octaan
Octan vindt verschillende toepassingen in verschillende industrieën vanwege de gunstige eigenschappen. Hier zijn enkele belangrijke toepassingen van octan:
- Brandstof: Octan wordt voornamelijk gebruikt als brandstofcomponent in benzine. Het verbetert het octaangetal van de brandstof, wat de motorprestaties verbetert, het kloppen vermindert en motorschade voorkomt. Dit is vooral belangrijk bij krachtige voertuigen en racewagens.
- Verbrandingsmotoren: Octan is cruciaal voor verbrandingsmotoren, inclusief die in auto’s, motorfietsen en kleine motoren. Het levert de energiebron die nodig is voor de werking en voortstuwing van voertuigen en machines.
- Chemische synthese: Octan dient als voorloper voor de productie van verschillende chemicaliën. Het wordt gebruikt als grondstof voor de synthese van andere koolwaterstofverbindingen, zoals alcoholen, aldehyden en zuren.
- Laboratoriumoplosmiddel: Octan wordt in laboratoria gebruikt als een niet-polair oplosmiddel. De lage polariteit maakt het geschikt voor het oplossen van niet-polaire verbindingen, waardoor onderzoekers bepaalde experimenten en extracties kunnen uitvoeren.
- Standaardreferentie: Om octaangetallen te bepalen en de prestaties van verschillende brandstoffen te vergelijken, gebruiken onderzoekers en experts octaan actief als referentie en referentieverbinding. Het helpt bij het vaststellen van normen voor de kwaliteit en efficiëntie van benzine en andere koolwaterstofbrandstoffen.
- Kalibratie: Octan wordt gebruikt bij de kalibratie van apparatuur, zoals gaschromatografen, om nauwkeurige en nauwkeurige metingen te garanderen. De bekende eigenschappen en het goed gekarakteriseerde gedrag maken het tot een betrouwbare kalibratiestandaard.
- Onderzoek en ontwikkeling: Octan is essentieel voor onderzoeks- en ontwikkelingsdoeleinden in de auto- en brandstofindustrie. Wetenschappers en ingenieurs bestuderen actief de eigenschappen, verbrandingseigenschappen en de impact op het milieu van octan om de brandstofefficiëntie te verbeteren, de uitstoot te verminderen en alternatieve brandstoffen te innoveren.
Octan stimuleert actief het transport, maakt chemische synthese mogelijk, vergemakkelijkt laboratoriumwerk en stimuleert vooruitgang in de auto- en energie-industrie.
Vragen:
Vraag: Welke verbinding heeft het hoogste smeltpunt?
A: Al2(CO3)3.
Vraag: Wat is de standaardvormingsenthalpie van dit C8H18(g)-isomeer?
A: De standaardvormingsenthalpie van het C8H18(g)-isomeer is specifiek voor het betreffende isomeer en vereist identificatie ervan om de waarde te bepalen.
Vraag: Wat is de massa in grammen van 5,90 mol C8H18?
A: De massa van 5,90 mol C8H18 is ongeveer 789,26 gram.
Vraag: Welke uitspraak vergelijkt het smeltpunt van butaan (C4H10) het beste met dat van octaan (C8H18)?
A: Octaan (C8H18) heeft een hoger smeltpunt dan butaan (C4H10).
Vraag: Wat is de naam van C8H18?
A: De naam van C8H18 is octaan.
Vraag: Wat is octaan?
A: Octaan is een alkaankoolwaterstof met de molecuulformule C8H18. Het wordt vaak gebruikt als brandbare component in benzine.
Vraag: Wat is het octaangetal van benzine?
A: Het octaangetal van benzine verwijst naar het vermogen om schokken tijdens de verbranding te weerstaan. Het geeft de antiklopeigenschappen van de brandstof aan en de geschiktheid ervan voor motoren met hoge compressie.
Vraag: Wat zijn octaangetal en cetaangetal?
A: Het octaangetal meet de antiklopeigenschappen van benzine, terwijl het cetaangetal de ontstekingskwaliteit van dieselbrandstof meet.
Vraag: Wat is octaan?
A: De octaanwaarde is een numerieke waarde die de prestaties van een brandstof weergeeft wat betreft het weerstaan van kloppen tijdens verbranding. Het geeft het vermogen van de brandstof aan om compressie te weerstaan vóór ontsteking.
Vraag: Wat is de naam van de koolwaterstof CH3(CH2)6CH3?
A: De naam van de koolwaterstof CH3(CH2)6CH3 is octaan.
