Nikkelsulfaat (NiSO4) is een verbinding bestaande uit nikkel-, zwavel- en zuurstofatomen. Het wordt vaak gebruikt bij het galvaniseren, in katalysatoren en als voedingsstof in sommige meststoffen.
| IUPAC-naam | Nikkel(II)sulfaat |
| Moleculaire formule | NiSO4 |
| CAS-nummer | 7786-81-4 |
| Synoniemen | Nikkelsulfaat, nikkelzout van zwavelzuur, nikkel (II) sulfaat, nikkel (2+); sulfaat |
| InChi | InChI=1S/Ni.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Eigenschappen van nikkelsulfaat
Nikkelsulfaatformule
De chemische formule voor nikkelsulfaat is NiSO4. Het vertegenwoordigt de combinatie van een nikkelatoom (Ni) en een sulfaatgroep (SO4). De formule geeft duidelijk de aanwezigheid aan van nikkel en zwavel, evenals zuurstof in de sulfaatgroep.
Nikkelsulfaat Molaire massa
De molaire massa van nikkelsulfaat (NiSO4) wordt berekend door de atoommassa’s van de samenstellende elementen bij elkaar op te tellen. Nikkel (Ni) heeft een atoommassa van ongeveer 58,69 gram per mol, terwijl zwavel (S) een atoommassa heeft van ongeveer 32,07 gram per mol en zuurstof (O) een atoommassa van ongeveer 16 gram per mol heeft. Door deze waarden op te tellen wordt bepaald dat de molmassa van nikkelsulfaat ongeveer 154,76 gram per mol bedraagt.
Kookpunt van nikkelsulfaat
Nikkelsulfaat heeft geen specifiek kookpunt omdat het bij verhitting ontleedt. Het is echter belangrijk op te merken dat de ontledingstemperatuur wordt beïnvloed door factoren zoals druk en de aanwezigheid van andere stoffen. Daarom wordt geadviseerd om voorzichtig om te gaan met nikkelsulfaat bij blootstelling aan hoge temperaturen.
Nikkelsulfaat Smeltpunt
Het smeltpunt van nikkelsulfaat ligt rond de 100 graden Celsius (212 graden Fahrenheit). Bij deze temperatuur verandert de vaste vorm van nikkelsulfaat in de vloeibare toestand. Het is de moeite waard te vermelden dat variaties in de zuiverheid en kristalstructuur van nikkelsulfaat het smeltpunt enigszins kunnen beïnvloeden.
Dichtheid van nikkelsulfaat g/ml
De dichtheid van nikkelsulfaat verwijst naar de massa per volume-eenheid. De dichtheid van nikkelsulfaat ligt doorgaans rond 3,68 gram per milliliter (g/ml). Opgemerkt moet worden dat de dichtheid kan variëren afhankelijk van de temperatuur en zuiverheid van het monster.
Nikkelsulfaat Molecuulgewicht
Het molecuulgewicht van nikkelsulfaat (NiSO4) is de som van de atoomgewichten van de samenstellende elementen. Zoals eerder vermeld is het molecuulgewicht van nikkelsulfaat ongeveer 154,76 gram per mol.
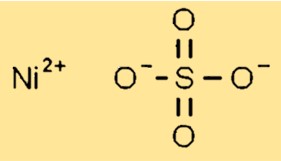
Structuur van nikkelsulfaat
Nikkelsulfaat heeft in vaste toestand een kristallijne structuur. Het vormt monokliene kristallen waarbij elk nikkel(Ni2+)-ion omgeven is door zes zuurstofatomen uit sulfaatgroepen. De sulfaatgroepen zijn zo gerangschikt dat een efficiënte verdichting van het kristalrooster mogelijk is.
Oplosbaarheid van nikkelsulfaat
Nikkelsulfaat heeft een matige oplosbaarheid in water. Het lost gemakkelijk op in water en de oplosbaarheid ervan neemt toe naarmate de temperatuur stijgt. De aanwezigheid van andere ionen en stoffen kan de oplosbaarheid ervan beïnvloeden. Bovendien kan nikkelsulfaat hydraten vormen wanneer het wordt gecombineerd met watermoleculen, wat leidt tot de vorming van verschillende nikkelsulfaathydraten.
| Verschijning | Blauw/groene kristallen |
| Soortelijk gewicht | 3,68 g/ml |
| Kleur | Blauw groen |
| Geur | Geurloos |
| Molaire massa | 154,76 g/mol |
| Dikte | 3,68 g/ml |
| Fusie punt | 100°C (212°F) |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water en organische oplosmiddelen zoals ethanol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | -1,1 (zwavelzuur) |
| pH | Zuur (ongeveer 4) |
Veiligheid en gevaren van nikkelsulfaat
Nikkelsulfaat brengt bepaalde veiligheidsrisico’s met zich mee waarmee rekening moet worden gehouden. Het is essentieel om er voorzichtig mee om te gaan om mogelijke risico’s te voorkomen. Direct huidcontact moet tot een minimum worden beperkt, aangezien dit huidirritatie of sensibilisatie kan veroorzaken. Inslikken of inademen van nikkelsulfaat moet worden vermeden, omdat dit nadelige gevolgen voor de gezondheid kan hebben. Bij het werken met nikkelsulfaat moeten geschikte persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril, worden gedragen om contact met de stof te voorkomen. Nikkelsulfaat moet op een koele, droge plaats worden bewaard, uit de buurt van onverenigbare materialen. Bij het werken met nikkelsulfaat is voldoende ventilatie noodzakelijk om de concentratie van in de lucht zwevende deeltjes te minimaliseren.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | – Vermijd contact met de huid – Vermijd inslikken en inademen – Draag geschikte persoonlijke beschermingsmiddelen |
| Identificatiegegevens van de Verenigde Naties | Niet toepasbaar |
| HS-code | 2833.25 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Kan huidirritatie of sensibilisatie veroorzaken |
Nikkelsulfaatsynthesemethoden
Er zijn verschillende methoden voor het synthetiseren van nikkelsulfaat.
Een gebruikelijke aanpak omvat de reactie tussen metallisch nikkel of nikkeloxide met zwavelzuur . Bij deze methode lost zwavelzuur metallisch Ni of nikkeloxide op, wat resulteert in de vorming van nikkelsulfaat. Je kunt de reactie uitvoeren onder gecontroleerde omstandigheden, zoals temperatuur en roeren, om een efficiënte conversie te garanderen.
Een andere methode omvat de reactie van zwavelzuur met nikkelcarbonaat. Zwavelzuur lost nikkelcarbonaat op en produceert nikkelsulfaat. Chemici gebruiken deze methode doorgaans als ze nikkelcarbonaat direct beschikbaar hebben, omdat dit een handig uitgangsmateriaal oplevert.
Bovendien kan zwavelzuur nikkelhydroxide oplossen om NiSO4 te synthetiseren. Het oplossen van nikkelhydroxide in zwavelzuur leidt tot de vorming van NiSO4. Deze methode is geschikt wanneer men nikkelhydroxide wil gebruiken als precursor voor de synthese van nikkelsulfaat.
Het is belangrijk op te merken dat u tijdens het syntheseproces de juiste veiligheidsmaatregelen moet volgen. Dit omvat het gebruik van geschikte beschermende uitrusting en hanteringsprocedures. Voer reacties uit in een goed geventileerde ruimte om het risico op blootstelling aan schadelijke dampen te minimaliseren. Zorgvuldige controle van reactieparameters, zoals temperatuur en concentratie, is cruciaal om een optimale nikkelsulfaatomzetting en opbrengst te garanderen.
Gebruik van nikkelsulfaat
Nikkelsulfaat heeft verschillende toepassingen in verschillende industrieën. Hier zijn enkele van de meest voorkomende toepassingen:
- Galvaniseren: Bij galvaniseerprocessen wordt uitgebreid gebruik gemaakt van nikkelsulfaat om een duurzame, corrosiebestendige coating op metalen oppervlakken te creëren. Nikkelsulfaat verbetert het uiterlijk, de hardheid en de sterkte van voorwerpen zoals sieraden, auto-onderdelen en keukengerei.
- Katalysator: Nikkelsulfaat fungeert als katalysator bij veel chemische reacties, waaronder hydrogenerings- en oxidatieprocessen. Industrieën gebruiken nikkelsulfaatkatalysatoren bij de productie van farmaceutische producten, petrochemicaliën en fijnchemicaliën.
- Batterijen: Oplaadbare batterijen, vooral Ni-Cd- en Ni-MH-batterijen, bevatten nikkelsulfaat als essentieel onderdeel. Nikkelsulfaat vergemakkelijkt elektrodereacties en zorgt voor een efficiënte opslag en vrijgave van elektrische energie.
- Meststof: Sommige meststoffen gebruiken oplosbaar Ni uit nikkelsulfaat om planten van essentiële voedingsstoffen te voorzien. Nikkel speelt een cruciale rol in verschillende metabolische processen in planten en draagt bij aan hun groei en ontwikkeling.
- Textiel: De textielindustrie gebruikt nikkelsulfaat in verf- en drukprocessen om de kleurechtheid en kleurabsorptie van stoffen te verbeteren. Nikkelsulfaat zorgt voor levendige, langdurige kleurresultaten.
- Farmaceutische producten: Nikkelsulfaat vindt toepassingen in farmaceutische preparaten, voornamelijk om medicijnen te produceren die Ni als actief ingrediënt bevatten of om specifieke Ni-complexen te formuleren die in medisch onderzoek worden gebruikt.
- Onderzoek en ontwikkeling: Laboratoria gebruiken nikkelsulfaat voor verschillende onderzoeks- en ontwikkelingsdoeleinden, waaronder chemische synthese, elektrochemische studies en materiaalwetenschappelijk onderzoek.
Vragen:
Vraag: Wat is de formule voor nikkel(II)sulfaat?
A: De formule voor nikkel(II)sulfaat is NiSO4.
Vraag: Metallisch chroom wordt toegevoegd aan een oplossing van nikkel (II) sulfaat. Wat is de uitgebalanceerde chemische reactie?
A: De uitgebalanceerde chemische reactie is: Cr + NiSO4 -> CrSO4 + Ni.
Vraag: Hoe maak ik nikkelammoniumsulfaat?
A: Nikkelammoniumsulfaat kan worden bereid door nikkelsulfaat en ammoniumsulfaat in water op te lossen, gevolgd door kristallisatie.
Vraag: Is nikkelsulfaat oplosbaar in water?
A: Ja, nikkelsulfaat is in water oplosbaar.
Vraag: Wie extraheert nikkelsulfaat?
A: Nikkelsulfaat wordt niet rechtstreeks gewonnen. Er worden nikkelertsen gewonnen en hieruit kan nikkelsulfaat worden geproduceerd.
Vraag: Wat is de naam van de verbinding NiSO4?
A: De verbinding NiSO4 wordt nikkelsulfaat genoemd.
Vraag: Hoeveel gram NiSO4 zit er in 100 g hydraat? Hoeveel mol?
A: De hoeveelheid NiSO4 in 100 g hydraat hangt af van de specifieke hydraatverbinding en de molaire massa ervan.
Vraag: Is NiSO4 oplosbaar in water?
A: Ja, NiSO4 is oplosbaar in water.
Vraag: Hoeveel gram NiSO4 wordt verkregen als de opbrengst 76,9% is?
A: De verkregen grammen NiSO4 zijn afhankelijk van de initiële hoeveelheid en de reactieomstandigheden.
Vraag: Is NiSO4 gevaarlijk?
A: NiSO4 kan gevaarlijk zijn als er niet op de juiste manier mee wordt omgegaan. Het is belangrijk om de veiligheidsinstructies te volgen als u ermee werkt.
Vraag: Wat is de naam van de covalente verbinding NiSO4?
A: NiSO4 is geen covalente verbinding. Het is een ionische verbinding genaamd nikkelsulfaat.
Vraag: Is NiSO4 een zout?
A: Ja, NiSO4 wordt als een zout beschouwd vanwege zijn ionische aard en de vorming ervan uit de reactie tussen een zuur (zwavelzuur) en een base (nikkelhydroxide).
Vraag: Wat is de lading van NiSO4?
A: In NiSO4 heeft het nikkelion (Ni2+) een positieve lading van 2+, terwijl het sulfaation (SO4 2-) een negatieve lading van 2- heeft.
