Nikkelnitraat (Ni(NO₃)₂) is een chemische verbinding die nikkel- en nitraationen bevat. Het is oplosbaar in water en wordt vaak gebruikt in katalysatoren, galvaniseren en als voorloper in andere nikkelverbindingen.
| IUPAC-naam | Nikkeldinitraat |
| Moleculaire formule | Ni(NO₃)₂ |
| CAS-nummer | 13138-45-9 |
| Synoniemen | Nikkel (II)nitraat, nikkelnitraat, Dinitronickel, nikkelbis(nitraat) |
| InChi | InChI=1S/2NO3.Ni/c2 2-1(3)4;/q2 -1;+2 |
Eigenschappen van nikkelnitraat
Nikkelnitraatformule
De chemische formule voor nikkeldinitraat is Ni(NO₃)₂. Het vertegenwoordigt een verbinding bestaande uit nikkelkationen (Ni) en nitraatanionen (NO₃). Het subscript “2” in de formule geeft aan dat er twee NO3-ionen zijn voor elk Ni+2-kation.
Nikkelnitraat Molaire massa
De molaire massa van nikkeldinitraat kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. Nikkel (Ni) heeft een molmassa van circa 58,69 g/mol, terwijl nitraat (NO3) een molmassa heeft van circa 62,00 g/mol. Als we ze bij elkaar optellen, bedraagt de molaire massa van nikkeldinitraat ongeveer 182,69 g/mol.
Kookpunt van nikkelnitraat
Het kookpunt van nikkeldinitraat verwijst naar de temperatuur waarbij het overgaat van een vloeistof naar een gas. Het kookpunt van nikkeldinitraat is ongeveer 136,7 graden Celsius (278,06 graden Fahrenheit). Het is echter essentieel op te merken dat deze waarde enigszins kan variëren, afhankelijk van de zuiverheid van de verbinding.
Nikkelnitraat smeltpunt
Het smeltpunt van nikkeldinitraat is de temperatuur waarbij het overgaat van een vaste naar een vloeibare toestand. Het smeltpunt van nikkeldinitraat is ongeveer 56,7 graden Celsius (134,06 graden Fahrenheit). Net als het kookpunt kan het smeltpunt worden beïnvloed door de zuiverheid van de verbinding.
Dichtheid van nikkelnitraat g/ml
De dichtheid van nikkeldinitraat is een maat voor de massa per volume-eenheid. Nikkeldinitraat heeft een dichtheid van ongeveer 1,68 g/ml. Deze waarde geeft aan dat het een hogere dichtheid heeft dan water, dat een dichtheid heeft van 1 g/ml.
Nikkelnitraat Molecuulgewicht
Het molecuulgewicht van nikkeldinitraat is de som van de atoomgewichten van alle atomen die aanwezig zijn in de chemische formule. Zoals eerder vermeld is het molecuulgewicht van nikkeldinitraat ongeveer 182,69 g/mol.
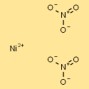
Structuur van nikkelnitraat
De structuur van nikkeldinitraat kan worden gevisualiseerd als nikkelkationen (Ni²⁺) omgeven door twee nitraatanionen (NO₃⁻) per kation. Nitraationen vormen gecoördineerde bindingen met nikkelkationen, waardoor een stabiele ionische verbinding ontstaat.
Oplosbaarheid van nikkelnitraat
Nikkeldinitraat is zeer oplosbaar in water en vormt een heldere groenachtig blauwe oplossing. De oplosbaarheid in water is een essentiële eigenschap, omdat het gemakkelijk kan worden gebruikt in verschillende toepassingen, zoals katalysatoren, galvaniseren en de productie van andere nikkelverbindingen.
| Verschijning | Groenachtig blauwe vaste stof |
| Soortelijk gewicht | 1,68 g/ml |
| Kleur | groenachtig blauw |
| Geur | Geurloos |
| Molaire massa | 182,69 g/mol |
| Dikte | 1,68 g/ml |
| Fusie punt | 56,7°C |
| Kookpunt | 136,7°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water en organische oplosmiddelen zoals ethanol |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Neutraal (ongeveer 7) |
Houd er rekening mee dat sommige eigenschappen mogelijk niet beschikbaar of relevant zijn voor nikkeldiitraat.
Veiligheid en gevaren van nikkelnitraat
Nikkeldinitraat brengt enkele veiligheidsrisico’s met zich mee en voorzichtigheid is geboden bij het hanteren ervan. Direct contact met de verbinding kan huid- en oogirritatie veroorzaken. Inademing van het stof of de dampen ervan kan irritatie van de luchtwegen veroorzaken. Het is essentieel om geschikte beschermende uitrusting te dragen, zoals handschoenen en een veiligheidsbril, wanneer u met nikkeldinitraat werkt. Vermijd inname omdat het schadelijk kan zijn voor de gezondheid. In geval van accidentele blootstelling dient u onmiddellijk medische hulp in te roepen. Bovendien is een goede opslag in een goed geventileerde ruimte, uit de buurt van onverenigbare stoffen, van cruciaal belang om potentiële risico’s te minimaliseren en een veilige hantering te garanderen.
| Gevarensymbolen | Bijtend, Irriterend, Gevaar voor de gezondheid |
| Beveiligingsbeschrijving | Veroorzaakt huid- en oogirritatie. Schadelijk bij inademing of inslikken. Breekbaar. Vermijd direct contact. Gebruik beschermende uitrusting. |
| VN-identificatienummers | VN2724 |
| HS-code | 2834.2990 |
| Gevarenklasse | 5.1 (Oxiderende stoffen) |
| Verpakkingsgroep | II |
| Toxiciteit | Matig giftig |
Methoden voor de synthese van nikkelnitraat
Er zijn verschillende methoden voor het synthetiseren van nikkeldinitraat. Een veelgebruikte methode is de reactie tussen nikkeloxide (NiO) of nikkelhydroxide (Ni(OH)₂) met salpeterzuur (HNO3). Tijdens dit proces lost nikkeloxide of nikkelhydroxide op in salpeterzuur, wat leidt tot de vorming van nikkeldinitraat en water als bijproducten.
De reactie kan de volgende representatie aannemen:
- Met nikkeloxide: NiO + 2HNO₃ → Ni(NO₃)₂ + H₂O
- Met nikkelhydroxide: Ni(OH)₂ + 2HNO₃ → Ni(NO₃)₂ + 2H₂O
Een andere benadering omvat de reactie tussen metallisch nikkel en geconcentreerd salpeterzuur, wat resulteert in de vorming van nikkeldinitraat en stikstofdioxidegas (NO₂) als bijproduct:
- Met nikkelmetaal: Ni + 4HNO₃ → Ni(NO₃)₂ + 2H₂O + 2NO₂
Het is belangrijk om deze reacties onder goed gecontroleerde omstandigheden uit te voeren, omdat salpeterzuur een sterk oxidatiemiddel is en gevaarlijk kan zijn. Zorg voor een veilig en succesvol resultaat tijdens het syntheseproces door actief gebruik te maken van passende veiligheidsmaatregelen en apparatuur. Bovendien kan de keuze van reagentia en reactieomstandigheden variëren afhankelijk van de specifieke toepassing en de gewenste eigenschappen van het nikkeldinitraatproduct.
Gebruik van nikkelnitraat
Nikkeldinitraat vindt vanwege zijn unieke eigenschappen meerdere toepassingen in verschillende industrieën. Hier zijn enkele van de belangrijkste toepassingen:
- Galvaniseren: Nikkeldinitraat maakt de afzetting van een dunne laag nikkel op verschillende metalen mogelijk, waardoor hun corrosieweerstand en uiterlijk worden verbeterd tijdens galvaniseerprocessen.
- Katalysator: Het speelt een cruciale rol als katalysator bij chemische reacties en vergemakkelijkt de omzetting van reactanten in gewenste producten, vooral bij organische synthese.
- Keramiek: De keramische industrie gebruikt nikkeldinitraat om specifieke kleurstoffen te geven en de prestaties van keramische materialen te verbeteren.
- Glasindustrie: Fabrikanten in de glasindustrie gebruiken nikkeldinitraat om gekleurd glas met gewenste optische eigenschappen te produceren.
- Batterijproductie: Fabrikanten gebruiken nikkeldinitraat bij de productie van op nikkel gebaseerde batterijen, inclusief nikkel-metaalhydride (NiMH) batterijen.
- Brandstofcellen: Nikkeldinitraat fungeert als een voorloper bij de vervaardiging van nikkeloxide-elektroden voor vaste-oxidebrandstofcellen (SOFC’s).
- Pyrotechniek: Bij pyrotechniek dient nikkeldinitraat als oxidatiemiddel, waardoor groene vlammen in vuurwerk ontstaan.
- Chemische reagentia: Het functioneert als reagens bij verschillende chemische reacties, vooral die waarbij nikkelcomplexen betrokken zijn.
- Meststoffen: In de landbouw wordt nikkeldinitraat af en toe gebruikt als bron van nikkel in meststoffen om nikkeltekorten in bepaalde gewassen aan te pakken.
De diverse toepassingen van nikkeldinitraat in verschillende industrieën benadrukken het belang ervan als een veelzijdige verbinding met een grote verscheidenheid aan praktische toepassingen.
Vragen:
Vraag: Wat slaat er neer als oplossingen van ammoniumfosfaat en nikkel(ii)nitraat worden gemengd?
A: Nikkel(II)fosfaat slaat neer.
Vraag: Wat is de molariteit van een oplossing die 5,8 gram nikkelnitraat bevat in 500 ml?
A: De molariteit is 0,2 M.
Vraag: Welke golflengten absorbeert nikkelnitraat?
A: Nikkeldinitraat absorbeert golflengten in de ultraviolette en zichtbare gebieden.
Vraag: Is nikkel II-nitraat oplosbaar?
A: Ja, nikkel(II)dinitraat is in water oplosbaar.
Vraag: Wat is de formule voor nikkel II-nitraat?
A: De formule is Ni(NO₃)₂.
Vraag: Wat is de kleur van nikkel II-nitraat?
A: De kleur van nikkel(II)dinitraat is groenachtig blauw.
Vraag: Hoeveel stikstofatomen zijn er in de chemische formule Ni(NO₃)₂?
A: Er zijn vier stikstofatomen.
Vraag: Is Ni(NO₃)₂ oplosbaar in water?
A: Ja, Ni(NO₃)₂ is oplosbaar in water.
Vraag: Welke van de verbindingen C4H10, BaCl2, Ni(NO₃)₂ en SF6 zouden als formule-eenheden moeten bestaan?
A: C4H10 (butaan) en SF6 (zwavelhexafluoride) zouden als formule-eenheden moeten bestaan. BaCl2 en Ni(NO₃)₂ zijn ionische verbindingen.
