Nikkelhydroxide (Ni(OH)2) is een chemische verbinding bestaande uit nikkel- en hydroxide-ionen. Het wordt vaak gebruikt als voorloper van op nikkel gebaseerde batterijen.
| Naam van IUPAC | Nikkelhydroxide |
| Moleculaire formule | Ni(OH)2 |
| CAS-nummer | 12054-48-7 |
| Synoniemen | Nikkel(II)hydroxide; Nikkelhydroxide; Stikstof Nikkeltrioxide (2+) |
| InChi | InChI=1S/Ni.2H2O/h;2*1H2/q+2;;/p-2 |
Eigenschappen van nikkelhydroxide
Nikkelhydroxideformule
De formule voor nikkelhydroxide is Ni(OH)2. Het bestaat uit één nikkelion (Ni) en twee hydroxide-ionen (OH-). Deze chemische formule vertegenwoordigt de samenstelling van nikkelhydroxide op atomair niveau.
Nikkelhydroxide molaire massa
De molaire massa van Ni(OH)2 wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. Nikkel heeft een atoommassa van 58,6934 g/mol en elk hydroxide-ion heeft een massa van 17,007 g/mol. Als je ze bij elkaar optelt, bedraagt de molaire massa van Ni(OH)2 ongeveer 92,6934 g/mol.
Kookpunt van nikkelhydroxide
Ni(OH)2 heeft geen duidelijk kookpunt, omdat het bij verhitting ontleedt. Bij hoge temperaturen ondergaat het thermische ontleding en wordt het omgezet in nikkeloxide (NiO) en waterdamp.
Smeltpunt van nikkelhydroxide
Het smeltpunt van Ni(OH)2 bedraagt ongeveer 230°C. Bij deze temperatuur ondergaat Ni(OH)2 een faseverandering van vaste naar vloeibare toestand. De verbinding smelt, waardoor verdere chemische reacties of behandelingen mogelijk zijn.
Dichtheid van nikkelhydroxide g/ml
De dichtheid van Ni(OH)2 bedraagt ongeveer 4,1 g/ml. Deze waarde vertegenwoordigt de massa van de verbinding per volume-eenheid. Het geeft de compactheid of concentratie van Ni(OH)2 in een bepaalde ruimte aan.
Nikkelhydroxide Molecuulgewicht
Het molecuulgewicht van Ni(OH)2 wordt bepaald door de atoomgewichten van de samenstellende elementen op te tellen. Nikkel heeft een atoomgewicht van 58,6934 g/mol en elk hydroxide-ion weegt 17,007 g/mol. Het molecuulgewicht van Ni(OH)2 bedraagt dus ongeveer 92,6934 g/mol.
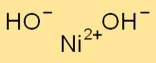
Structuur van nikkelhydroxide
Ni(OH)2 kristalliseert in het hexagonale kristalsysteem. Het vormt lagen van Ni+2- en OH–ionen die op elkaar zijn gestapeld. Ni+2-ionen worden op gecoördineerde wijze omgeven door OH-ionen, waardoor een netwerkstructuur ontstaat.
Oplosbaarheid van nikkelhydroxide
Ni(OH)2 is slecht oplosbaar in water. Het lost tot op zekere hoogte op en vormt een licht alkalische oplossing vanwege de aanwezigheid van hydroxide-ionen. De oplosbaarheid van Ni(OH)2 kan worden beïnvloed door factoren als temperatuur en pH.
| Verschijning | Stevig groen |
| Soortelijk gewicht | 4,1 g/ml |
| Kleur | Groente |
| Geur | Geurloos |
| Molaire massa | 92,6934 g/mol |
| Dikte | 4,1 g/ml |
| Fusie punt | 230°C |
| Kookpunt | Ontbonden |
| Flitspunt | N.v.t |
| oplosbaarheid in water | Enigszins oplosbaar |
| Oplosbaarheid | Onoplosbaar, vormt een alkalische oplossing in water |
| Dampdruk | N.v.t |
| Dampdichtheid | N.v.t |
| pKa | N.v.t |
| pH | Alkalisch |
Veiligheid en gevaren van nikkelhydroxide
Ni(OH)2 brengt bepaalde veiligheidsrisico’s met zich mee waarmee rekening moet worden gehouden. Het kan de huid, ogen en luchtwegen irriteren bij contact of inademing. Langdurige of herhaalde blootstelling kan leiden tot sensibilisatie en allergische reacties veroorzaken. Het is belangrijk om voorzichtig met Ni(OH)2 om te gaan en passende beschermende maatregelen te nemen, zoals handschoenen, een veiligheidsbril en een gasmasker. Als inslikken of accidentele blootstelling plaatsvindt, moet onmiddellijk medische hulp worden ingeroepen. Bovendien wordt Ni(OH)2 beschouwd als een gevaar voor het milieu en moet het op de juiste manier worden verwijderd volgens de regelgeving om verontreiniging van bodem- of waterbronnen te voorkomen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | – Kan huid- en oogirritatie veroorzaken\n- Kan irritatie van de luchtwegen veroorzaken\n- Overgevoeligheid mogelijk\n- Volg de juiste procedures voor behandeling en verwijdering |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 2825.70.10 |
| Gevarenklasse | Niet geclassificeerd als gevaarlijk |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Beschouwd als lage tot matige toxiciteit |
Houd er rekening mee dat gevarensymbolen en VN-identificaties niet van toepassing zijn op Ni(OH)2, omdat het niet als gevaarlijke stof is geclassificeerd. De gegeven beschrijving van de veiligheid benadrukt de potentiële risico’s en voorzorgsmaatregelen die gepaard gaan met het hanteren van Ni(OH)2. De toxiciteit van Ni(OH)2 wordt over het algemeen als laag tot matig beschouwd.
Nikkelhydroxidesynthesemethoden
Er zijn verschillende synthetische methoden beschikbaar voor de productie van Ni(OH)2. Een gebruikelijke methode omvat de reactie tussen een oplosbaar nikkelzout, zoals nikkelsulfaat of nikkelnitraat, en een alkalisch hydroxide, gewoonlijk natriumhydroxide of kaliumhydroxide. De reactie vindt plaats in een waterige oplossing onder gecontroleerde omstandigheden, wat resulteert in de vorming van Ni(OH)2 als neerslag.
Bij de elektrochemische afzettingsmethode gebruikt de elektrolytische cel metallisch nikkel als elektrode. Het past een geschikte elektrische stroom toe om de nikkelionen uit de elektrolyt te verminderen en deze op de elektrode af te zetten in de vorm van Ni(OH)2. Deze methode maakt nauwkeurige controle mogelijk van de samenstelling en morfologie van het resulterende Ni(OH)2.
De thermische ontleding van nikkelzouten maakt de productie van Ni(OH)2 mogelijk. Door een nikkelzout, zoals nikkelcarbonaat of Ni(OH)2 zelf, in een gecontroleerde omgeving te verwarmen, ondergaat de verbinding ontleding, waarbij Ni(OH)2 en andere bijproducten worden geproduceerd.
Het is vermeldenswaard dat de keuze van de synthesemethode afhangt van factoren zoals de gewenste zuiverheid, deeltjesgrootte en specifieke toepassingsvereisten. Bij het selecteren van de juiste syntheseroute voor de productie van Ni(OH)2 moet men het gewenste resultaat zorgvuldig overwegen vanwege de voordelen en beperkingen die aan elke methode zijn verbonden.
Gebruik van nikkelhydroxide
Ni(OH)2 vindt diverse toepassingen vanwege zijn unieke eigenschappen. Hier zijn enkele veelvoorkomende toepassingen van Ni(OH)2:
- Batterijproductie: Ni(OH)2 speelt een cruciale rol als kathodemateriaal in op nikkel gebaseerde batterijen, zoals nikkel-cadmium (NiCd) en nikkel-metaalhydride (NiMH) batterijen. Het slaat elektrische energie op en geeft deze vrij, waardoor efficiënte energieopslag mogelijk is.
- Katalysator: Ni(OH)2 fungeert als katalysator bij verschillende chemische reacties, waaronder hydrogenerings- en oxidatieprocessen. De katalytische eigenschappen ervan vergemakkelijken de efficiënte omzetting van reactanten in gewenste producten.
- Galvaniseren: Ni(OH)2 vormt een stabiele, hechtende nikkellaag, waardoor het waardevol is bij galvanische toepassingen. Het biedt een beschermende, corrosiebestendige en esthetisch aantrekkelijke coating op verschillende metalen oppervlakken.
- Pigmenten: Fabrikanten gebruiken Ni(OH)2 als groen pigment bij de productie van keramiek, glas en kunststoffen. De levendige groene kleur versterkt de esthetische waarde van deze materialen.
- Gassensoren: Op Ni(OH)2 gebaseerde sensoren detecteren en monitoren gassen zoals waterstof, ammoniak en waterstofsulfide. Veranderingen in de elektrische geleidbaarheid van Ni(OH)2-films maken een efficiënte detectie van deze gassen mogelijk.
- Waterbehandeling: Ni(OH)2 ondersteunt waterbehandelingsprocessen door selectief zware metalen, zoals lood en cadmium, te adsorberen en te verwijderen. Het vertoont affiniteit voor deze metalen, waardoor het nuttig is voor de verwijdering ervan uit waterbronnen.
- Farmaceutische toepassingen: Ni(OH)2 vindt toepassing in farmaceutische formuleringen en dient als bindmiddel, desintegratiemiddel of pH-regulator in tablet- of capsuleformuleringen.
Dit zijn slechts enkele voorbeelden van de verschillende toepassingen van Ni(OH)2, die de veelzijdigheid en het belang ervan in verschillende industrieën aantonen.
Vragen:
Vraag: Wat is de chemische formule voor basisch nikkel(II)hydroxide?
A: De chemische formule voor nikkel(II)hydroxide is Ni(OH)2.
Vraag: Is nikkelhydroxide oplosbaar in water?
A: Ni(OH)2 is onoplosbaar in water.
Vraag: Hoeveel gram nikkel(II)chloride is nodig om 75,0 ml 0,555 M lithiumhydroxide te neutraliseren?
A: Het benodigde aantal grammen nikkelchloride kan worden berekend met behulp van de stoichiometrie en molariteit van de lithiumhydroxideoplossing.
Vraag: Welke lading vertegenwoordigt Ni(OH)2?
A: De lading van Ni(OH)2 is neutraal of nul.
Vraag: Hoe bereken je de molaire oplosbaarheid van Ni(OH)2?
A: De molaire oplosbaarheid van Ni(OH)2 kan worden bepaald door het aantal mol opgeloste verbinding te delen door het volume van de oplossing.
Vraag: Wat is de uitgebalanceerde vorm van de vergelijking NaOH(aq) + NiCl2(aq) → NaCl(aq) + Ni(OH)2(s)?
A: De uitgebalanceerde vergelijking is 2NaOH(aq) + NiCl2(aq) → 2NaCl(aq) + Ni(OH)2(s).
Vraag: Hoeveel gram per mol is Ni(OH)2?
A: De molaire massa van Ni(OH)2 is ongeveer 92,6934 g/mol.
Vraag: Is Ni(OH)2 oplosbaar in water?
A: Nee, Ni(OH)2 is onoplosbaar in water.
Vraag: Wat is het reductiemiddel in de reactie: Mg + NiO2 + 2H2O → Mg(OH)2 + Ni(OH)2?
A: Het reductiemiddel in de reactie is magnesium (Mg).
Vraag: Is Ni(OH)2 een vaste stof?
A: Ja, Ni(OH)2 is een vaste verbinding.
Vraag: Als de cel een potentieel van 0,247 V heeft bij 25°C, wat is dan de Ksp van Ni(OH)2?
A: De Ksp van Ni(OH)2 kan worden bepaald met behulp van de Nernst-vergelijking en celpotentiaal.
Vraag: Welke zouten zijn beter oplosbaar in een zure oplossing dan in zuiver water?
A: Zouten zoals Ni(OH)2 zullen beter oplosbaar zijn in een zure oplossing vanwege de neutralisatiereactie met het zuur.
